题目内容
高温下,某反应达到平衡,平衡常数K=
.恒容时,温度升高,H2浓度减小.下列说法正确的是( )
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| A、该反应的焓变为正值 |
| B、恒温恒容下,增大压强,H2浓度一定减小 |
| C、升高温度,逆反应速率减小 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:平衡常数指可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,平衡常数k=
,所以该反应化学方程式应为CO2+H2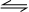 CO+H2O,恒容时,温度升高,H2 浓度减小,平衡向正反应移动,则该反应为吸热反应,以此来解答.
CO+H2O,恒容时,温度升高,H2 浓度减小,平衡向正反应移动,则该反应为吸热反应,以此来解答.
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
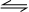 CO+H2O,恒容时,温度升高,H2 浓度减小,平衡向正反应移动,则该反应为吸热反应,以此来解答.
CO+H2O,恒容时,温度升高,H2 浓度减小,平衡向正反应移动,则该反应为吸热反应,以此来解答.解答:
解:A、恒容时,温度升高,H2浓度减小,则该反应为吸热反应,所以△H>0,故A正确;
B、恒温恒容下,若通入氢气,增大压强,则H2浓度增大,故B错误;
C、升高温度,正、逆反应速率都增大,故C错误.
故选A.
B、恒温恒容下,若通入氢气,增大压强,则H2浓度增大,故B错误;
C、升高温度,正、逆反应速率都增大,故C错误.
故选A.
点评:本题考查化学平衡常数、影响化学平衡的因素等,难度中等,注意对化学平衡常数的理解,同一反应化学计量数不同平衡常数不同.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目
每做一次焰色反应实验,都要用一种试剂洗净铂丝,这种试剂是( )
| A、Na2CO3溶液 |
| B、NaOH溶液 |
| C、硫酸 |
| D、盐酸 |
下列物质放置在空气中,因发生氧化还原反应而变质的是( )
| A、NaCl |
| B、NaOH |
| C、Na2CO3?10H2O |
| D、Na2O2 |
下列有关烃的叙述正确的是( )
| A、戊烷分子中的五个碳原子可以处在同一条直线上 |
| B、C4H6分子中的四个碳原子不可能处在同一条直线上 |
| C、C6H12分子中六个碳原子不可能处于同一平面上 |
D、 分子中至少有10个碳原子处于同一平面上 分子中至少有10个碳原子处于同一平面上 |
利用核能发电的基本工作原理是:原子核发生裂变反应,释放大量热能,使水变为水蒸气,推动汽轮机发电.核反应堆中发生裂变反应的主要材料是
U,即
U原子核受到外来中子轰击,一个原子核吸收一个中子分裂成两个较小的原子核,同时放出2~3个中子,裂变产生的中子又去轰击另外的
U,引起新的裂变,下列有关说法不正确的是( )
235 |
235 |
235 |
| A、核能是不可再生能源,若使用不当,可能会对环境造成污染 | ||
| B、大力发展核能,可缓解能源短缺问题,也有利于降低碳排放 | ||
C、
| ||
| D、核能发电过程中实现了“热能→机械能→电能”的转化 |
500K时,有CO催化剂加氢反应:CO(g)+3H2(g)?CH4(g)+H2O(g)△H<0,下列有关说法正确的是( )
| A、温度升高时,该反应的平衡常数K增大 |
| B、缩小容器体积,平衡体系中各物质的浓度均增大 |
| C、温度越低,越有有利于CO催化氢 |
| D、从平衡体系中分离出H2O(g)能加快正反应速率 |
反应A2(g)+3B2(g)?4C2(g)+2D2(g)在5L密闭容器中进行,半分钟后,C2的物质的量增加了0.3mol,则此反应的平均速率
(x)( )
. |
| v |
A、
| ||
B、
| ||
C、
| ||
D、
|
实验表明,在一定条件下,乙烯和水反应可表示为:C2H4(g)+H2O(g)═C2H5OH(g)△H=-45.8kJ/mol
则下列说法中正确的是( )
则下列说法中正确的是( )
| A、实验中,乙烯的用量不会影响该反应的反应焓变△H |
| B、0.5molH2O(l)完全反应放出的热量为22.9kJ |
| C、1molC2H5OH(g)具有的能量大于1molC2H4(g)和1molH2O(g)所具有的能量和 |
| D、1molC2H4(g)和1molH2O (g)中化学键的总键能大于1molC2H5OH(g)中化学键的总键能 |
下列化学用语表示正确的是( )
| A、乙酸的分子式:CH2O |
| B、乙烯的结构简式:CH2CH2 |
C、Cl-的结构示意图: |
D、HBr的形成过程: |