题目内容
8.北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).(1)已知11g丙烷完全燃烧生成CO2和液态水时放出的热量为555kJ,请写出丙烷燃烧热的热化学方程式C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2220kJ•mol-1;
(2)以丙烷为燃料制作燃料电池,电解质是熔融碳酸盐,电池的负极应通入C3H8或丙烷,电池的正极反应式为O2+2CO2+4e-═2CO32-;放电时,CO32-移向电池的负(选填“正”或“负”)极.
分析 (1)先计算出11g丙烷的物质的量,然后计算出1mol丙烷燃烧放出的热量,据此形出丙烷燃烧的热化学方程式;
(2)燃料电池中,负极燃烧失去电子,则负极为丙烷,电极反应式为C3H8-20e-+10CO32-=13CO2+4H2O,正极反应式为:O2+2CO2+4e-=2CO32-,电解质溶液中阴离子向负极移动.
解答 解:(1)11g丙烷的物质的量为:$\frac{11g}{44g/mol}$=0.25mol,则1mol丙烷完全燃烧放出的热量为:55kJ×$\frac{1mol}{0.25mol}$=2220kJ,则丙烷燃烧的热化学方程式为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2220 kJ•mol-1,
故答案为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2220 kJ•mol-1;
(2)燃料电池中,负极上燃料C3H8或丙烷失电子发生氧化反应,正极上氧化剂得电子发生还原反应,负极电极反应式为C3H8-20e-+10CO32-=13CO2+4H2O,正极反应式为:O2+2CO2+4e-=2CO32-,所以其电池反应式为C3H8+5O2═3CO2+4H2O,放电时,电解质中阴离子移动方向与电流方向相反,则碳酸根离子向负极移动,
故答案为:C3H8+5O2═3CO2+4H2O;负.
故答案为:C3H8或丙烷; O2+2CO2+4e-═2CO32-;负.
点评 本题考查了热化学方程式的书写、原电池工作原理,题目难度中等,明确原电池工作原理为解答关键,注意掌握热化学方程式的书写原则,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
9.下列单质或化合物的描述正确的是( )
| A. | 明矾溶于水产生具有吸附性的胶体粒子,可作漂白剂 | |
| B. | 植物油分子中有碳碳双键,与H2加成后可以得到人造脂肪 | |
| C. | CO2、CH4、N2等均是造成温室效应的气体 | |
| D. | Fe在少量Cl2中燃烧生成FeCl2 |
10.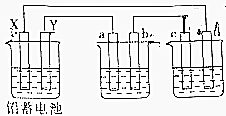 用铅蓄电池电解AgNO3、Na2SO3的溶液,a、b、c、d电极材料均为石墨.已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$2PbSO4(s)+2H2O(l),通电时a电极质量增加,下列说法正确的是( )
用铅蓄电池电解AgNO3、Na2SO3的溶液,a、b、c、d电极材料均为石墨.已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$2PbSO4(s)+2H2O(l),通电时a电极质量增加,下列说法正确的是( )
 用铅蓄电池电解AgNO3、Na2SO3的溶液,a、b、c、d电极材料均为石墨.已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$2PbSO4(s)+2H2O(l),通电时a电极质量增加,下列说法正确的是( )
用铅蓄电池电解AgNO3、Na2SO3的溶液,a、b、c、d电极材料均为石墨.已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$2PbSO4(s)+2H2O(l),通电时a电极质量增加,下列说法正确的是( )| A. | 电路中通过1mol电子时,Y电极质量增加48g | |
| B. | 放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+SO${\;}_{4}^{2-}$(aq)+2e-=PbSO4(s)+2H2O(l) | |
| C. | c、d电极产生气体的物质的量之比为1:2 | |
| D. | X极为负极 |
20.短周期主族元素X、Y、Z、W的原子序数依次增大,X是形成化合物种类最多的元素,Y原子最外层电子数是其内层电子数的2倍,W是地壳中含量最多的元素.下列叙述正确的是( )
| A. | Y与W可以组成YW32-、Y2W42- | |
| B. | 由X、Y、Z、W四种元素组成的既能与酸又能与碱反应的化合物,一定属于α-氨基酸 | |
| C. | 若化合物Y2X4W2能发生银镜反应,则该化合物一定是甲酸甲酯 | |
| D. | 混合物Y7X8、Y3 X8W3中X的质量分数约为8.7% |
18.绿色化学的核心是反应过程的绿色化,即要求原料物质中的所有原子完全被利用且全部转入期望的产品中,下列过程不符合这一思想的是( )
| A. | 甲烷、CO合成乙酸乙酯:2CH4+2CO$\stackrel{催化剂}{→}$CH3COOCH2CH3 | |
| B. | 烯烃与水煤气发生的羰基合成反应:RCH═CH2+CO+H2$\stackrel{催化剂}{→}$RCH2CH2CHO | |
| C. | 葡萄糖在酒化酶作用下转化为酒精 | |
| D. | 氯乙烯合成聚氯乙烯 |
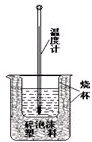 实验室利用如图装置进行中和热的测定.回答下列问题:
实验室利用如图装置进行中和热的测定.回答下列问题: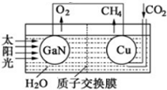 氮化镓是目前最热门的半导体材料,应用前景非常广阔.已有科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4,装置如图所示,回答下列问题:
氮化镓是目前最热门的半导体材料,应用前景非常广阔.已有科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4,装置如图所示,回答下列问题:

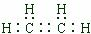 ;B中含官能团名称是羟基.
;B中含官能团名称是羟基.