题目内容
Fe、Al、N、S等元素的单质及其化合物对人类的生产生活有着重要的作用.
(1)画出硫原子的原子结构示意图 .
(2)向Fe、Al的混合物中加入足量NaOH溶液产生无色气体.该过程中发生反应的离子方程式为 .
(3)硝酸被称为“国防工业之母”,工业上一般以氨气为原料来制备硝酸.氨气催化氧化的化学方程式为 .
(4)自然界中化合态硫主要以FeS2(黄铁矿)、CuFeS2(黄铜矿)等矿物形式存在.用黄铜矿炼铜的总反应为:2CuFeS2+2SiO2+5O2
2Cu+2FeSiO3+4SO2,反应中 元素被还原.将SO2气体通入BaCl2溶液中无明显现象,再通入少量氯气后有白色沉淀生成.该过程中发生反应的离子方程式为 .
(1)画出硫原子的原子结构示意图
(2)向Fe、Al的混合物中加入足量NaOH溶液产生无色气体.该过程中发生反应的离子方程式为
(3)硝酸被称为“国防工业之母”,工业上一般以氨气为原料来制备硝酸.氨气催化氧化的化学方程式为
(4)自然界中化合态硫主要以FeS2(黄铁矿)、CuFeS2(黄铜矿)等矿物形式存在.用黄铜矿炼铜的总反应为:2CuFeS2+2SiO2+5O2
| ||
考点:铝的化学性质,画元素的原子结构示意图,氧化还原反应
专题:
分析:(1)根据硫原子共有16个质子来画原子结构示意图;
(2)根据铁和氢氧化钠不反应,铝具有两性,可以与强碱反应生成偏铝酸钠和氢气来书写;
(3)NH3与O2在催化剂、加热条件下发生反应生成NO和H2O;
(4)根据CuFeS2中Cu的化合价为+2,Fe为+2价,S为-2价,反应中Cu和O元素化合价降低,S元素化合价升高来分析;通Cl2与二氧化硫发生氧化还原反应生成硫酸根离子,生成硫酸钡沉淀,据此书写离子方程式.
(2)根据铁和氢氧化钠不反应,铝具有两性,可以与强碱反应生成偏铝酸钠和氢气来书写;
(3)NH3与O2在催化剂、加热条件下发生反应生成NO和H2O;
(4)根据CuFeS2中Cu的化合价为+2,Fe为+2价,S为-2价,反应中Cu和O元素化合价降低,S元素化合价升高来分析;通Cl2与二氧化硫发生氧化还原反应生成硫酸根离子,生成硫酸钡沉淀,据此书写离子方程式.
解答:
解:(1)硫原子共有16个质子,则原子结构示意图为: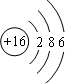 ,故答案为:
,故答案为: ;
;
(2)铁和氢氧化钠不反应,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,离子反应方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)NH3与O2在催化剂、加热条件下发生反应生成NO和H2O:4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O;
(4)CuFeS2中Cu的化合价为+2,则Fe为+2价,S为-2价,反应中Cu和O元素化合价降低,被还原,通Cl2与二氧化硫发生氧化还原反应生成硫酸根离子,生成硫酸钡沉淀,离子方程式为:SO2+Cl2+2H2O+Ba2+═2Cl-+BaSO4↓+4H+,故答案为:Cu、O;SO2+Cl2+2H2O+Ba2+═2Cl-+BaSO4↓+4H+.
 ,故答案为:
,故答案为: ;
;(2)铁和氢氧化钠不反应,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,离子反应方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)NH3与O2在催化剂、加热条件下发生反应生成NO和H2O:4NH3+5O2
| ||
| △ |
| ||
| △ |
(4)CuFeS2中Cu的化合价为+2,则Fe为+2价,S为-2价,反应中Cu和O元素化合价降低,被还原,通Cl2与二氧化硫发生氧化还原反应生成硫酸根离子,生成硫酸钡沉淀,离子方程式为:SO2+Cl2+2H2O+Ba2+═2Cl-+BaSO4↓+4H+,故答案为:Cu、O;SO2+Cl2+2H2O+Ba2+═2Cl-+BaSO4↓+4H+.
点评:本题主要考查了铝的两性,氨气的催化氧化,二氧化硫及其氧化还原反应的性质,题目难度不大,把握发生的化学反应为解答的关键,注重基础知识夯实.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法中,不正确的是( )
| A、室温下NH3?H2O分子可能存在于pH=6的酸性溶液中 |
| B、在0.1mol?L-1氢氧化钠中加入适量的蒸馏水,溶液的c(H+)增大 |
| C、由水电离出的c(H+)=1×10-12mol?L-1的溶液中,AlO2-不可能大量存在 |
| D、在c(H+)=c(OH-)的溶液中,CO32-不可能大量存在 |
已知A、B、C、D分别是Cu、Na、Mg、Al四种金属中的一种.已知①A不能与稀硫酸反应放出气体;②B和D分别放入冷水中,B与冷水剧烈反应且产生大量气泡;③常温下C在浓硫酸中钝化且与强碱反应放出气体,由此可以推断A、B、C、D依次是( )
| A、Mg、Cu、Na、Al |
| B、Al、Cu、Na、Mg |
| C、Cu、Na、Al、Mg |
| D、Cu、Mg、Na、Al |
下列关于丙炔(CH3-C≡CH)的说法正确的是( )
| A、丙炔分子中有6个σ键,2个π键 |
| B、丙炔分子中3个碳原子都是sp杂化 |
| C、丙炔分子中只存在极性键 |
| D、丙炔分子中的π键比σ键稳定 |
根据元素周期律和物质结构的有关知识,以下有关排序正确的是( )
| A、离子半径:Ca2+>Cl->S2- |
| B、非金属性:Si>C>N |
| C、电负性:F>S>Mg |
| D、热稳定性:CH4>H2S>NH3 |


 +CO
+CO

