题目内容
8.氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为( )| A. | 两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化 | |
| B. | NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道 | |
| C. | NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强 | |
| D. | 甲烷中心原子的价电子全部成键且成键的对象相同 |
分析 NH3中N原子成3个σ键,有一对未成键的孤对电子,杂化轨道数为4,采取sp3型杂化杂化,孤对电子对成键电子的排斥作用较强,氨气分子空间构型是三角锥形;CH4分子中C原子采取sp3型杂化杂化,杂化轨道全部用于成键,碳原子连接4个相同的原子,为正四面体构型.
解答 解:NH3中N原子成3个σ键,有一对未成键的孤对电子,杂化轨道数为4,采取sp3型杂化杂化,孤对电子对成键电子的排斥作用较强,N-H之间的键角小于109°28′,所以氨气分子空间构型是三角锥形;CH4分子中C原子采取sp3型杂化杂化,杂化轨道全部用于成键,碳原子连接4个相同的原子,C-H之间的键角相等为109°28′,故CH4为正四面体构型,故AB错误,CD正确.
故选CD.
点评 本题考查了分子空间构型的判断,难度中等,注意理解价层电子对互斥理论与杂化轨道理论.

练习册系列答案
相关题目
4.在一定条件下,RO3n-和I-发生反应的离子方程式为RO3n-+6I-+6H+═R-+3I2+3H2O,则RO3n-中R元素的化合价与R元素的最外层电子数分别为( )
| A. | +5,7 | B. | +5,5 | C. | +7,7 | D. | +6,6 |
16.原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数与其电子层数相等,X、Z的最外层电子数之和与Y、W的最外层电子数之和相等,Z为非金属性最强的元素.下列说法正确的是( )
| A. | 原子半径:W>Y>Z,而简单离子的半径:Z>Y>W | |
| B. | W的氯化物水溶液中通入XY3至过量,现象是先生成白色沉淀,后逐渐溶解 | |
| C. | Z的非金属性强于Y,因此其最高价氧化物对应水化物的酸性强于Y | |
| D. | YX3沸点远高于YZ3的原因是YX3存在分子间氢键 |
13.下列说法中正确的是( )
| A. | 通过红外光谱分析不能区分乙醇和乙酸 | |
| B. | 95%(体积分数)的乙醇溶液常用于医疗消毒 | |
| C. | 乙醇和乙酸都能发生氧化反应 | |
| D. | 酯化反应和酯的碱性水解反应互为可逆反应 |
17.如表是A、B、C、D四种有机物的有关信息
回答下列问题:
(1)A与Br2的CCl4溶液反应的生成物的名称是1,2-二溴乙烷.
(2)B不能使溴水因发生化学反应而褪色,性质类似烷烃,任写一个B发生取代反应的化学方程式: +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$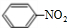 +H2O
+H2O
(3)C与Na反应的化学方程式为2CH3CH2OH+2Na→2CH3CH2ONa+H2↑.
(4)C和D反应生成相对分子质量为100的酯,该反应的反应类型为酯化反应(取代反应),其化学方程式为CH2=CH-COOH+CH3CH2OH$→_{△}^{催化剂}$CH2=CH-COOCH2CH3+H2O.
| A | ①能使溴的四氯化碳溶液褪色; ②比例模型为  ; ;③能与水在一定条件下反应生成物质C |
| B | ①由C和H两种元素组成; ②比例模型为  |
| C | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与D反应生成相对分子质量为100的酯 |
| D | ①由C、H、O三种元素组成; ②球棍模型为  |
(1)A与Br2的CCl4溶液反应的生成物的名称是1,2-二溴乙烷.
(2)B不能使溴水因发生化学反应而褪色,性质类似烷烃,任写一个B发生取代反应的化学方程式:
 +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$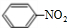 +H2O
+H2O(3)C与Na反应的化学方程式为2CH3CH2OH+2Na→2CH3CH2ONa+H2↑.
(4)C和D反应生成相对分子质量为100的酯,该反应的反应类型为酯化反应(取代反应),其化学方程式为CH2=CH-COOH+CH3CH2OH$→_{△}^{催化剂}$CH2=CH-COOCH2CH3+H2O.
18.下列对应关系正确的是( )
| A. | 淀粉[(C6H10O5)n]与纤维素[(C6H10O5)n]--互为同分异构体 | |
| B. | CH4与 C2H4--互为同系物 | |
| C. | O2与O3--同一物质 | |
| D. | 136C与126C--不同核素 |
