题目内容
计算题:
实验室用锌跟足量的稀硫酸反应制取氢气,若要制得4.48L(标准状态)氢气,需要多少摩尔锌?同时生成ZnSO4多少克?
实验室用锌跟足量的稀硫酸反应制取氢气,若要制得4.48L(标准状态)氢气,需要多少摩尔锌?同时生成ZnSO4多少克?
考点:化学方程式的有关计算
专题:计算题
分析:根据n=
计算氢气的物质的量,再根据Zn+H2SO4Cl=ZnSO4+H2↑计算参加反应锌、生成硫酸锌的物质的量,再根据m=nM计算硫酸锌的质量.
| V |
| Vm |
解答:
解:标况下,4.48L氢气的物质的量为
=0.2mol,令生成的氢气的物质的量为n,则:
Zn+H2SO4Cl=ZnSO4+H2↑
1 1 1
x y 0.2mol
所以x=y=
=0.2mol
故生成硫酸锌的质量=0.2mol×161g/mol=32.2g
答:需要锌的物质的量为0.2mol,生成硫酸锌的质量为32.2g.
| 4.48L |
| 22.4L/mol |
Zn+H2SO4Cl=ZnSO4+H2↑
1 1 1
x y 0.2mol
所以x=y=
| 0.2mol×1 |
| 1 |
故生成硫酸锌的质量=0.2mol×161g/mol=32.2g
答:需要锌的物质的量为0.2mol,生成硫酸锌的质量为32.2g.
点评:本题考查学生根据方程式的计算,比较基础,旨在考查学生对基础知识的掌握,掌握根据方程式计算的方法.

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案
相关题目
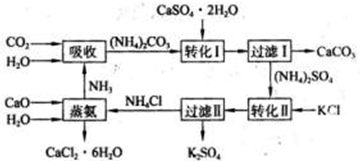
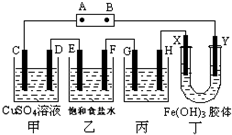 课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:
课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:
 空气质量与我们的健康息息相关,目前我国通过监测6项污染物的百分比浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物.
空气质量与我们的健康息息相关,目前我国通过监测6项污染物的百分比浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物.