题目内容
4.下列说法正确的是( )| A. | pH=6的溶液一定显酸性 | |
| B. | 25℃时,0.1mol/L的NaHB溶液呈酸性,说明H2B为强酸 | |
| C. | NH4Cl、CH3COONa、NaHCO3、NaHSO4溶于水,对水的电离都有促进作用 | |
| D. | 0.1mol/L CH3COOH和0.05mol/L NaOH溶液等体积混合,所得溶液中:2c(Na+)═c(CH3COO-)+c(CH3COOH) |
分析 A.100℃时pH=6为中性;
B.25℃时,0.1mol/L的NaHB溶液呈酸性,可知HB-的电离大于其水解;
C.NH4Cl、CH3COONa、NaHCO3均水解促进水的电离,而NaHSO4溶于水抑制水的电离;
D.等体积混合,醋酸的物质的量为NaOH物质的量的2倍,结合物料守恒来解答.
解答 解:A.100℃时pH=6为中性,未指明温度时pH=6的溶液不能确定酸碱性,故A错误;
B.25℃时,0.1mol/L的NaHB溶液呈酸性,可知HB-的电离大于其水解,H2B可能为弱酸,如亚硫酸,故B错误;
C.NH4Cl、CH3COONa、NaHCO3均水解促进水的电离,而NaHSO4溶于水抑制水的电离,对水的电离影响不同,故C错误;
D.等体积混合,醋酸的物质的量为NaOH物质的量的2倍,则2c(Na+)═c(CH3COO-)+c(CH3COOH),故D正确;
故选D.
点评 本题考查酸碱混合,为高频考点,把握水解、电离及物料守恒为解答的关键,侧重分析与应用能力的考查,注意选项A为易错点,题目难度不大.

练习册系列答案
 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
14.下列有关性质的比较不正确的是( )
| A. | 非金属性:Cl>Br | B. | 酸性:H2SO4>H3PO4 | ||
| C. | 碱性:KOH>NaOH | D. | 热稳定性:Na2CO3<NaHCO3 |
15.下列实验操作和现象对应的结论错误的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 向溶液X中滴加BaCl2溶液,有白色沉淀生成 | 溶液X中可能含有SO42- |
| B | 物质的量之比为2:3的稀硝酸和稀硫酸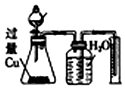 | 反应结束后,锥形瓶中溶液的溶质是CuSO4,集气瓶中收集到的气体是NO |
| C | 向1mL浓度均为0.05mol•L-1NaCl、NaI的混合溶液中滴加2滴0.01mol•L-1 AgNO3溶液,振荡,沉淀是黄色 | Ksp(AgCl)<Ksp(AgI) |
| D | 室温下,用pH试纸测得0.1mol•L-1NaHSO3溶液的pH约为5 | HSO3-的电离程度大于其水解程度 |
| A. | A | B. | B | C. | C | D. | D |
12.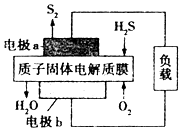 H2S废气资源利用的途径之一是回收并得到S2(g).反应原理为2H2S(g)+O2(g)═S2(g)+2H2O(1)△H=-632kJ•mol-1.如图所示为H2S燃料电池的结构示意图.下列说法正确的是( )
H2S废气资源利用的途径之一是回收并得到S2(g).反应原理为2H2S(g)+O2(g)═S2(g)+2H2O(1)△H=-632kJ•mol-1.如图所示为H2S燃料电池的结构示意图.下列说法正确的是( )
 H2S废气资源利用的途径之一是回收并得到S2(g).反应原理为2H2S(g)+O2(g)═S2(g)+2H2O(1)△H=-632kJ•mol-1.如图所示为H2S燃料电池的结构示意图.下列说法正确的是( )
H2S废气资源利用的途径之一是回收并得到S2(g).反应原理为2H2S(g)+O2(g)═S2(g)+2H2O(1)△H=-632kJ•mol-1.如图所示为H2S燃料电池的结构示意图.下列说法正确的是( )| A. | 电池工作时,电子从电极a经质子固体电解质膜流向电极b | |
| B. | 电极a上发生的电极反应为2H2S+4OH--4e-═S2+4H2O | |
| C. | 当电路中通过2 mol电子时,有2 mol H+经质子固体电解质膜进入正极区 | |
| D. | 当反应中生成64 g S2时,电池内部有632KJ的能量转化为电能 |
19.已知松油醇的结构简式如图,下列说法错误的是( )


| A. | 松油醇的分子式为C10H18O | B. | 松油醇分子只含一种官能团 | ||
| C. | 松油醇能使酸性KMnO4溶液褪色 | D. | 松油醇能发生取代反应和加成反应 |
2.下列关于中和热测定的实验描述正确的是( )
| A. | 需要用到的仪器是酒精灯,烧杯,温度计,量筒,环形玻璃搅拌棒 | |
| B. | 中和热测定可以是所有的酸和碱 | |
| C. | 环形玻璃搅拌棒的搅拌方式是上下搅动 | |
| D. | 实验所取NaOH物质的量稍大于HCl,会导致中和热的数值偏高 |
9.下列叙述正确的是( )
| A. | 熔融状态下或在水溶液中能自身电离出自由移动的离子的化合物是电解质 | |
| B. | 凡是在水溶液里和熔化状态下都不能导电的物质叫非电解质 | |
| C. | 能导电的物质一定是电解质 | |
| D. | 某物质若不是电解质,就一定是非电解质 |
6.下列反应既属于氧化还原反应又属于放热反应的是( )
| A. | CH3COOH溶液与NaOH溶液混合 | B. | Al与Fe2O3高温下的铝热反应 | ||
| C. | KMnO4分解制氧气 | D. | Na2CO3在溶液中的水解 |
7.下列实验方案能达到实验目的是( )
| 选项 | 实验方案 | 实验目的或结论 |
| A | 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 可证明氧化性:H2O2比Fe3+强 |
| B | 向1mL 1%的NaOH溶液中加入2mL 2%的CuSO4溶液,振荡,再加入0.5mL有机物Y,加热,未出现砖红色沉淀 | 说明Y中不含醛基 |
| C | 取a g铝箔与足量氢氧化钠溶液充分反应,逸出的气体通过浓硫酸后,测其体积为V L(已转化为标准状况下) | 测定铝箔中氧化铝的含量 |
| D | 比较不同反应的反应热数据大小 | 从而判断反应速率的大小 |
| A. | A | B. | B | ||
| C. | C D.D |