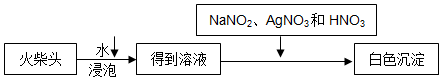
题目内容
2.沉淀的生成、溶解和转化在无机制备和提纯以及科研等领域有广泛应用.已知BaSO4的Ksp=1×10-10,BaCO3的Ksp=1×10-9(1)将浓度均为0.1mol•L-1的BaCl2溶液与Na2SO4溶液等体积混合,充分搅拌后过滤,滤液中c(Ba2+)=1×10-5mol•L-1
(2)万一误服了少量BaCO3,应尽快用大量0.5mol•L-1Na2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为2×10-10mol•L-1.
分析 (1)浓度均为0.1mol•L-1的BaCl2溶液与Na2SO4溶液等体积混合,Qc=0.1mol/L×$\frac{1}{2}$×0.1mol/L×$\frac{1}{2}$=2.5×10-3>Ksp=1×10-10,可知生成BaSO4沉淀;
(2)BaSO4的Ksp=1×10-10,c(Ba2+)=$\frac{Ksp(BaS{O}_{4})}{c(S{{O}_{4}}^{2-})}$,以此来解答.
解答 解:(1)浓度均为0.1mol•L-1的BaCl2溶液与Na2SO4溶液等体积混合,Qc=0.1mol/L×$\frac{1}{2}$×0.1mol/L×$\frac{1}{2}$=2.5×10-3>Ksp=1×10-10,可知生成BaSO4沉淀,钡离子沉淀完全,充分搅拌后过滤,滤液中c(Ba2+)=1×10-5mol•L-1,
故答案为:1×10-5;
(2)BaSO4的Ksp=1×10-10,用大量0.5mol•L-1Na2SO4溶液给患者洗胃,忽略洗胃过程中Na2SO4溶液浓度的变化,c(Ba2+)=$\frac{Ksp(BaS{O}_{4})}{c(S{{O}_{4}}^{2-})}$=$\frac{1×1{0}^{-10}}{0.5}$=2×10-10mol/L,
故答案为:2×10-10.
点评 本题考查难溶电解质的生成,为高频考点,把握Ksp的计算及应用、沉淀生成的判断为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.氮的固定是几百年来科学家一直研究的课题.
(1)如表列举了不同温度下大气固氮和工业固氮的部分K值.
①分析数据可知:大气固氮反应属于吸热 (填“吸热”或“放热”)反应.
②分析数据可知:人类不适合大规模模拟大气固氮的原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因从反应速率角度考虑,高温更好,温度越高平衡逆向进行,但从催化剂活性和反应速率等综合因素考虑选择500℃左右合适
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,如图所示的图示中,正确的是A (填“A”或“B”);比较р1、р2的大小关系р2>р1.

(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是N2+6e-+6H+=2NH3
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:
2N2(g)+6H2O(1)?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.(已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1)
(5)液氨和水类似,也能自离解(电离):NH3+NH3═NH4++NH2-.25℃时,液氨的离子积K=1.0×10-30. 若将NaNH2固体加入液氨中,则所得溶液中不存在的关系式是(设温度保持不变)a(选填编号)
a.c(Na+)=c(NH2-) b.c(NH4+)•c(NH2-)=1.0×10-30 c.c(NH2-)>c(NH4+)
(6)若在液氨中NaNH2和NH4Cl都能完全电离,则用标准NaNH2液氨溶液滴定未知浓度NH4Cl液氨溶液时,反应的离子方程式为NH4++NH2-=2NH3.
(1)如表列举了不同温度下大气固氮和工业固氮的部分K值.
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 25 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 20 | 0.152 |
②分析数据可知:人类不适合大规模模拟大气固氮的原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因从反应速率角度考虑,高温更好,温度越高平衡逆向进行,但从催化剂活性和反应速率等综合因素考虑选择500℃左右合适
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,如图所示的图示中,正确的是A (填“A”或“B”);比较р1、р2的大小关系р2>р1.

(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是N2+6e-+6H+=2NH3
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:
2N2(g)+6H2O(1)?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.(已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1)
(5)液氨和水类似,也能自离解(电离):NH3+NH3═NH4++NH2-.25℃时,液氨的离子积K=1.0×10-30. 若将NaNH2固体加入液氨中,则所得溶液中不存在的关系式是(设温度保持不变)a(选填编号)
a.c(Na+)=c(NH2-) b.c(NH4+)•c(NH2-)=1.0×10-30 c.c(NH2-)>c(NH4+)
(6)若在液氨中NaNH2和NH4Cl都能完全电离,则用标准NaNH2液氨溶液滴定未知浓度NH4Cl液氨溶液时,反应的离子方程式为NH4++NH2-=2NH3.
18.向含有c(FeCl3)=0.2mol/L、c(FeCl2)=0.1mol/L的混合溶液中滴加稀NaOH溶液,可得到一种黑色分散系,其中分散质粒子是直径约为9.3nm的金属氧化物,下列相关说法正确的是( )
| A. | 该分散系的分散质为Fe2O3 | |
| B. | 可用过滤的方法将黑色金属氧化物与Na+分离开 | |
| C. | 向沸水中逐滴滴加0.1 mol/L FeCl3溶液也可得到Fe(OH)3胶体 | |
| D. | 加入NaOH溶液时发生的反应可能为:Fe2++2Fe3++8OH-═Fe3O4+4H2O |
7.为探究Na2SO3溶液的性质,某学习小组设计了一系列实验,并记录实验现象.具达如下表所示.
则以下说法不正确的是( )
| 实验装置 | 实验序号 | 滴管试剂 | 试管试剂 | 实验现象 |
 | ① | 0.2mol/LNa2SO3溶液 | 品红溶液 | 红色消失 |
| ② | 饱和Ag2SO4浊液 | 产生白色沉淀 | ||
| ③ | 0.2mol/L CuSO4溶液 | 溶液先变绿,继续滴加产生砖红色沉淀 | ||
| ④ | 0.lmol/L Al2(SO4)溶液 | 开始无明显现象,继续滴加产生白色沉淀,并有刺激性气味的气体生成 |
| A. | Na2SO3溶液具有漂白性 | |
| B. | Ksp(Ag2SO4)<Ksp(Ag2SO3) | |
| C. | 实验③,SO32-与Cu2+发生了氧化还原反应 | |
| D. | 实验④发生反应的离子方程式为:3SO32-+2Al3++3H2O═2Al(OH)3↓+3SO2↑ |
14.下列有关物质的性质和该性质的应用均正确的是( )
| A. | 常温下铝与浓硫酸不发生反应,故常温下可用铝制容器贮运浓硫酸 | |
| B. | 碳酸钠可与盐酸反应,故常用于治疗胃溃疡病人的胃酸过多症 | |
| C. | 氧化铝具有很高的熔点,故可用于制造阻燃剂或耐高温材料 | |
| D. | 二氧化硫、潮湿的氯气均具有漂白性,故其混合物的漂白效果会更好 |
11.关于碱金属的性质叙述错误的是( )
| A. | 还原性随原子电子层数的增加而增加 | |
| B. | 在空气中燃烧的生成物都是过氧化物 | |
| C. | 与水反应的剧烈程度随核电荷数增加而增强 | |
| D. | 最高价氧化物对应水化物的碱性随核电荷数增加而增强 |
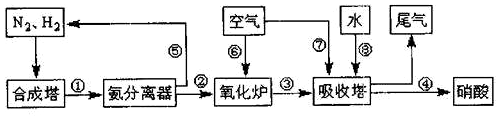


 ,D与E反应的现象是有白烟生成;D在催化剂作用下被氧气氧化是工业制备硝酸的主要反应之一,已知1molD被催化氧化生成气态物质放出aKJ的热量,请写出该反应的热化学反应方程式4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H=-4akJ/mol.
,D与E反应的现象是有白烟生成;D在催化剂作用下被氧气氧化是工业制备硝酸的主要反应之一,已知1molD被催化氧化生成气态物质放出aKJ的热量,请写出该反应的热化学反应方程式4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H=-4akJ/mol.