题目内容
 如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时,V(A)=V(B)=a L.在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:X+Y2?2Z+W△H<0(X、Y、Z、W均为气体),达到平衡时,V(A)=1.2aL.试回答:
如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时,V(A)=V(B)=a L.在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:X+Y2?2Z+W△H<0(X、Y、Z、W均为气体),达到平衡时,V(A)=1.2aL.试回答:(1)A中X的转化率α(A)=
40%
40%
.(2)A、B中X转化率的关系:α(A)
>
>
α(B)(填“>”“=”或“<”).(3)打开K,一段时间又达平衡时,A的体积为
2.6a
2.6a
L(连通管中气体体积不计).(4)在(3)达平衡后,同时等幅升高A、B的温度,达新平衡后A的体积
减小
减小
(填“变大”“不变”或“变小”)分析:(1)A为恒温恒压过程,体积之比等于物质的量之比,据此计算平衡后A中平衡时混合气体的物质的量,根据差量法计算参加反应的X的物质的量,利用转化率定义计算;
(2)A为恒温恒压容器,B为恒温恒容容器,反应前后是气体体积不变的反应,A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,B容器相当增大压强,平衡逆向进行,平衡后A中的X的转化率大;
(3)反应前后气体的物质的量不变,故打开K保持温度不变,又达到平衡与开始A中充入1mol X、1mol Y到达的平衡相同,根据X的转化率计算转化的X的物质的量,进而计算平衡后总的物质的量增大量,计算平衡后混合气体总的物质的量,再根据体积之比等于物质的量之比计算总体积,进而计算A容器的体积,据此判断;
(4)在(3)达平衡后,同时等幅升高A、B的温度,X+Y?2Z+W△H<0,反应是放热反应,升温平衡逆向进行.
(2)A为恒温恒压容器,B为恒温恒容容器,反应前后是气体体积不变的反应,A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,B容器相当增大压强,平衡逆向进行,平衡后A中的X的转化率大;
(3)反应前后气体的物质的量不变,故打开K保持温度不变,又达到平衡与开始A中充入1mol X、1mol Y到达的平衡相同,根据X的转化率计算转化的X的物质的量,进而计算平衡后总的物质的量增大量,计算平衡后混合气体总的物质的量,再根据体积之比等于物质的量之比计算总体积,进而计算A容器的体积,据此判断;
(4)在(3)达平衡后,同时等幅升高A、B的温度,X+Y?2Z+W△H<0,反应是放热反应,升温平衡逆向进行.
解答:解:(1)A为恒温恒压过程,达到平衡时VA=1.2a L,等压等温条件下,气体的体积之比等于气体的物质的量之比,所以平衡后混合气体的物质的量是2mol×1.2=2.4mol,设参加反应的X的物质的量为m mol,则:
X(g)+Y(g)?2Z(g)+W(g) 物质的量增多
1mol 1mol
mmol (2.4-2)mol
所以,m=0.4
所以X物质的转化率=
×100%=40%;
故答案为:40%;
(2)A为恒温恒压容器,B为恒温恒容容器,反应前后是气体体积不变的反应,A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,B中压强增大平衡逆向进行,X的转化率减小,平衡后A中的X的转化率大于B中X的转化率;
故答案为:>;
(3)打开K达新平衡等效为A中到达的平衡,X的转化率为40%,参加反应的X的总的物质的量为3mol×40%=1.2mol,则:
X(g)+Y(g)?2Z(g)+W(g) 物质的量增多
1mol 1mol
1.2mol 1.2mol
故平衡后容器内总的物质的量为(1mol+1mol+2mol+2mol)+1.2mol=7.2mol,气体的体积之比等于气体的物质的量之比,则总容器的体积为aL×
=3.6a,则A的体积为3.6a-a=2.6a;
故答案为:2.6a;
(4)在(3)达平衡后,同时等幅升高A、B的温度,达新平衡后A的体积,X+Y?2Z+W△H<0,反应是放热反应,升温平衡逆向进行,A容器体积减小,故答案为:减小.
X(g)+Y(g)?2Z(g)+W(g) 物质的量增多
1mol 1mol
mmol (2.4-2)mol
所以,m=0.4
所以X物质的转化率=
| 0.4mol |
| 1mol |
故答案为:40%;
(2)A为恒温恒压容器,B为恒温恒容容器,反应前后是气体体积不变的反应,A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,B中压强增大平衡逆向进行,X的转化率减小,平衡后A中的X的转化率大于B中X的转化率;
故答案为:>;
(3)打开K达新平衡等效为A中到达的平衡,X的转化率为40%,参加反应的X的总的物质的量为3mol×40%=1.2mol,则:
X(g)+Y(g)?2Z(g)+W(g) 物质的量增多
1mol 1mol
1.2mol 1.2mol
故平衡后容器内总的物质的量为(1mol+1mol+2mol+2mol)+1.2mol=7.2mol,气体的体积之比等于气体的物质的量之比,则总容器的体积为aL×
| 7.2mol |
| 2mol |
故答案为:2.6a;
(4)在(3)达平衡后,同时等幅升高A、B的温度,达新平衡后A的体积,X+Y?2Z+W△H<0,反应是放热反应,升温平衡逆向进行,A容器体积减小,故答案为:减小.
点评:本题考查化学平衡的建立和变化过程中气体体积的变化,体积之比等于物质的量之比,注意AB容器的条件应用,题目难度较大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
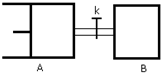 如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始VA=VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应 X(g)+Y(g)?2Z(g)+W(g)达到平衡时,VA=1.2aL,则下列说法正确的是( )
如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始VA=VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应 X(g)+Y(g)?2Z(g)+W(g)达到平衡时,VA=1.2aL,则下列说法正确的是( )| A、反应开始时,B容器中化学反应速率快 | B、A容器中X的转化率为40%,且比B容器中X的转化率小 | C、打开K一段时间达平衡时,A的体积为1.6aL(连通管中气体体积不计) | D、打开K达新平衡后,升高B容器温度,A容器体积一定增大 |
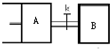 如图所示,向A中充入1mol X和1mol Y,向B中充入2molX和2molY,起始VA=VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g)?2Z(g)+W(g)△H>0;达到平衡时,VA=1.2aL,则下列说法错误的是( )
如图所示,向A中充入1mol X和1mol Y,向B中充入2molX和2molY,起始VA=VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g)?2Z(g)+W(g)△H>0;达到平衡时,VA=1.2aL,则下列说法错误的是( )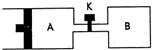 如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始VA=VB=aL,在相同温度和有催化剂的条件下,两容器内各自发生下列反应:X(g)+Y(g)?2Z(g)+W(g);△H>0,达到平衡时,VA=1.2a L.则下列说法不正确的是( )
如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始VA=VB=aL,在相同温度和有催化剂的条件下,两容器内各自发生下列反应:X(g)+Y(g)?2Z(g)+W(g);△H>0,达到平衡时,VA=1.2a L.则下列说法不正确的是( )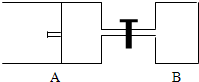 如图所示,向A中充入 1mol X和1mol Y,向B中充入 2mol X和2mol Y,起始时VA=VB=aL.在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:X+Y?2Z+W;正反应为放热反应,(四物质均为气体).达到平衡时.VA=1.2a L,试回答:(A在的活塞可移动)
如图所示,向A中充入 1mol X和1mol Y,向B中充入 2mol X和2mol Y,起始时VA=VB=aL.在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:X+Y?2Z+W;正反应为放热反应,(四物质均为气体).达到平衡时.VA=1.2a L,试回答:(A在的活塞可移动)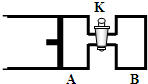 如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始VA=VB=aL,在相同的温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g)?2Z(g)+W(g);△H>0 达到平衡时,VA=1.2aL.则下列说法错误的是( )
如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始VA=VB=aL,在相同的温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g)?2Z(g)+W(g);△H>0 达到平衡时,VA=1.2aL.则下列说法错误的是( )