题目内容
2.根据如图的转化关系(反应条件已略去),判断下列说法正确的是( )
| A. | 反应①中氧化剂与还原剂的物质的量之比为1:4 | |
| B. | 反应②属于非氧化还原反应 | |
| C. | 相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1 | |
| D. | 根据反应⑤可判断还原性:Al>Mn |
分析 A.①中Mn元素的化合价有+4价降低为+2价,HCl中Cl元素的化合价由-1价升高为0;
B.反应②氯气与氢氧化钙反应生成氯化钙和次氯酸钙;
C.③中O元素的化合价由-1价升高为0,④中O元素的化合价有-2价升高为0;
D.可用铝热反应冶炼锰.
解答 解:A.反应①4HCl(浓)+MnO2 $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中Mn元素的化合价由+4价降低为+2价,HCl中Cl元素的化合价由-1价升高为0,由电子守恒可知,氧化剂与还原剂的物质的量之比为1:2,故A错误;
B.反应②氯气与氢氧化钙反应生成氯化钙和次氯酸钙,Cl元素化合价发生变化,属于氧化还原反应,故B错误;
C.③中O元素的化合价由-1价升高为0,④中O元素的化合价有-2价升高为0,则相同条件下生成等量的O2,反应③和④转移的电子数之比为1:2,故C错误;
D.用铝热反应冶炼锰,反应中铝表现为还原性,由还原剂还原性大于还原产物还原性可知还原性:Al>Mn,故D正确.
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,注意元素的化合价判断及电子守恒应用,题目难度不大.

练习册系列答案
相关题目
12.某矿石样品中可能含铁,为确定其成分,进行如下操作:

下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 向溶液乙中滴加KSCN溶液,溶液颜色变红,则原矿石样品中存在Fe3+ | |
| B. | 向溶液乙中滴加少量氢氧化钠溶液,一定出现红褐色沉淀 | |
| C. | 向溶液甲中滴加KSCN溶液,溶液颜色变红,则原矿石样品中存在Fe3+ | |
| D. | 该矿石一定为赤铁矿 |
13.CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示.下列说法正确的是( )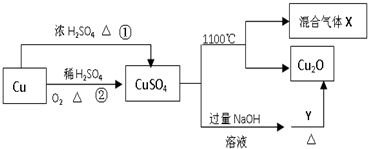

| A. | 途径①和途径②都体现了硫酸的酸性和氧化性 | |
| B. | 将CuSO4溶液蒸发浓缩、冷却结晶,可制得胆矾晶体 | |
| C. | CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体 | |
| D. | Y可以是酒精溶液 |
17. 某同学用40mL 0.50mol/L盐酸和40mL 0.55mol/L NaOH
某同学用40mL 0.50mol/L盐酸和40mL 0.55mol/L NaOH
溶液反应,测定强酸与强碱反应的反应热,装置如图所示.请回答下列问题.
(1)图示实验装置中缺少的一种仪器是环形玻璃搅拌棒,大、小烧杯间填满泡沫塑料的作用是减少实验过程中的热量损失.
(2)若大烧杯上不盖硬纸板,测得的△H将偏大(填“偏大”、“偏小”或“无影响”).
(3)该同学实验数据记录如下.
假设0.50mol/L盐酸和0.55mol/LNaOH溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).依据实验数据计算,生成1mol水时的反应热△H=-51.83kJ/mol.
 某同学用40mL 0.50mol/L盐酸和40mL 0.55mol/L NaOH
某同学用40mL 0.50mol/L盐酸和40mL 0.55mol/L NaOH溶液反应,测定强酸与强碱反应的反应热,装置如图所示.请回答下列问题.
(1)图示实验装置中缺少的一种仪器是环形玻璃搅拌棒,大、小烧杯间填满泡沫塑料的作用是减少实验过程中的热量损失.
(2)若大烧杯上不盖硬纸板,测得的△H将偏大(填“偏大”、“偏小”或“无影响”).
(3)该同学实验数据记录如下.
| 温度实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
14.2.3g纯净物金属钠在干燥空气中被氧化后得到3.5g固体,由此可判断其氧化产物是( )
| A. | 只有Na2O | B. | 只有Na2O2 | C. | Na2O和Na2O2 | D. | 无法确定 |
12.下列说法正确的是( )
| A. | 物质都是由元素组成的 | |
| B. | 两种元素只能形成一种化合物 | |
| C. | 物质的分类有多个标准,但是酸只有一种分类标准,即含氧酸和无氧酸 | |
| D. | 酸性氧化物均能与碱反应生成盐和水 | |
| E. | 酸性氧化物均能与水反应生成相应的酸 | |
| F. | 碱性氧化物均能与水反应生成相应的碱 |
 4-甲基-1-戊烯
4-甲基-1-戊烯 苯甲酸
苯甲酸




 B.
B. 与
与 C.
C. 与
与 D.
D. 与
与 E.
E. 与
与 F.2-甲基丁烷和2,2-二甲基丙烷.
F.2-甲基丁烷和2,2-二甲基丙烷.