题目内容
黑火药是中国四大发明之一,其爆炸反应的化学方程式是:
2KNO3+3C+S→ +N2↑+3CO2↑
+N2↑+3CO2↑
完成下列填空:
(1)化学方程式中的第二周期元素非金属性由强到弱的顺序依次为 .
(2)N2的电子式为 .
(3)生成物A的化学式为 ;其晶体类型为 ;构成晶体A的微粒半径大小关系为 (用微粒符号表示).
(4)说明氮元素的非金属性比碳元素强的事实是 .
2KNO3+3C+S→
 +N2↑+3CO2↑
+N2↑+3CO2↑完成下列填空:
(1)化学方程式中的第二周期元素非金属性由强到弱的顺序依次为
(2)N2的电子式为
(3)生成物A的化学式为
(4)说明氮元素的非金属性比碳元素强的事实是
考点:非金属在元素周期表中的位置及其性质递变的规律,电子式,不同晶体的结构微粒及微粒间作用力的区别,氧化还原反应
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:(1)同周期从左到右非金属性逐渐增强;
(2)根据N原子的最外层电子数,及氮气的结构式分析;
(3)利用质量守恒定律来分析解答;根据微粒之间的作用力分析;电子层结构相同的离子,原子序数越大,半径越小;
(4)根据非金属最高价氧化物对应的水化物的酸性来比较.
(2)根据N原子的最外层电子数,及氮气的结构式分析;
(3)利用质量守恒定律来分析解答;根据微粒之间的作用力分析;电子层结构相同的离子,原子序数越大,半径越小;
(4)根据非金属最高价氧化物对应的水化物的酸性来比较.
解答:
解:(1)已知化学方程式是:2KNO3+3C+S→ +N2↑+3CO2↑,根据同周期从左到右非金属性逐渐增强,所以非金属性由强到弱的顺序依次为:O、N、C;
+N2↑+3CO2↑,根据同周期从左到右非金属性逐渐增强,所以非金属性由强到弱的顺序依次为:O、N、C;
故答案为:O、N、C;
(2)氮原子最外层有5个电子,需3个电子达稳定结构,N2的结构式为N≡N,所以其电子式为 ,
,
故答案为: ;
;
(3)由化学方程式为S+2KNO3+3C→X+N2↑+3CO2↑,根据质量守恒定律可知,反应前后元素种类、原子个数相等,则A的化学式为K2S;
K2S中K+与S2-之间以离子键结合,所以其晶体类型为离子晶体;K+与S2-的电子层结构相同,原子序数越大,半径越小,则S2->K+;
故答案为:K2S;离子晶体;S2->K+;
(4)非金属最高价氧化物对应的水化物的酸性越强,则元素的非金属性越强,硝酸酸性比碳酸强说明氮元素的非金属性比碳元素强;
故答案为:硝酸酸性比碳酸强.
 +N2↑+3CO2↑,根据同周期从左到右非金属性逐渐增强,所以非金属性由强到弱的顺序依次为:O、N、C;
+N2↑+3CO2↑,根据同周期从左到右非金属性逐渐增强,所以非金属性由强到弱的顺序依次为:O、N、C;故答案为:O、N、C;
(2)氮原子最外层有5个电子,需3个电子达稳定结构,N2的结构式为N≡N,所以其电子式为
 ,
,故答案为:
 ;
;(3)由化学方程式为S+2KNO3+3C→X+N2↑+3CO2↑,根据质量守恒定律可知,反应前后元素种类、原子个数相等,则A的化学式为K2S;
K2S中K+与S2-之间以离子键结合,所以其晶体类型为离子晶体;K+与S2-的电子层结构相同,原子序数越大,半径越小,则S2->K+;
故答案为:K2S;离子晶体;S2->K+;
(4)非金属最高价氧化物对应的水化物的酸性越强,则元素的非金属性越强,硝酸酸性比碳酸强说明氮元素的非金属性比碳元素强;
故答案为:硝酸酸性比碳酸强.
点评:本题考查了非金属性的比较、电子式、质量守恒的应用、晶体类型的判断、半径比较等,题目涉及的知识点较多,侧重于基础知识的考查,难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
下列关于能量变化的说法正确的是( )
| A、冰融化成水放出热量 |
| B、化学键断裂过程一定放出能量 |
| C、生成物的总能量一定低于反应物的总能量 |
| D、化学键的断裂和形成是化学反应中能量变化的主要原因 |
把铝片(去除氧化膜后)放入下列各溶液中,发生化学反应,但无气体产生的是( )
| A、稀盐酸 | B、硫酸铜溶液 |
| C、氯化镁溶液 | D、苛性钠溶液 |

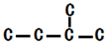 ,此烷烃的一溴代物有
,此烷烃的一溴代物有 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水的处理主要包括水的净化、污水处理、硬水软化和海水的淡化等.
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水的处理主要包括水的净化、污水处理、硬水软化和海水的淡化等. ,请写出ABS的结构简式
,请写出ABS的结构简式