题目内容
最近有科学家提出“绿色自由”的构想:把含有CO2的空气吹入K2CO3溶液中,然后再用高温水气分解出CO2,经与H2化合后转变为甲醇燃料.
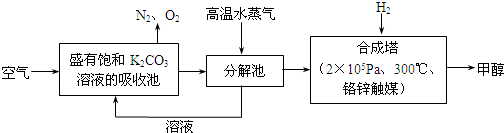
(1)在整个生产过程中饱和K2CO3溶液的作用是 ;不用KOH溶液的理由是 .
(2)在合成塔中,每44g CO2与足量H2完全反应生成甲醇时,可放出49.5kJ的热量,试写出合成塔中发生反应的热化学方程式 ;转化过程中可循环利用的物质除了K2CO3外,还有 .
(3)请评述合成时选择2×105Pa的理由 .
(4)BaCO3的溶解平衡可以表示为 BaCO3(s)?Ba2++CO32-
①写出平衡常数表达式 ;
②用重量法测定空气中CO2的体积分数时,选用Ba(OH)2而不是Ca(OH)2为沉淀剂,原因之一是:25℃时,BaCO3的溶解平衡常数K=2.58×10-9,而CaCO3的溶解平衡常数K=4.96×10-9;原因之二是 .
(5)某同学很快就判断出以下中长石风化的离子方程式未配平:
4Na0.5Ca0.5Al1.5Si2.5O6+6CO2+17H2O→2Na++2Ca2++5HCO3-+4H4SiO4+3Al2SiO5(OH)4
该同学判断的角度是 .
(6)甲醇可制成新型燃料电池,总反应为:2CH3OH+3O2+4KOH→2K2CO3+6H2O该电池负极的电极反应式为:CH3OH-6e+8OH-→CO32-+6H2O则正极的电极反应式为: .

(1)在整个生产过程中饱和K2CO3溶液的作用是
(2)在合成塔中,每44g CO2与足量H2完全反应生成甲醇时,可放出49.5kJ的热量,试写出合成塔中发生反应的热化学方程式
(3)请评述合成时选择2×105Pa的理由
(4)BaCO3的溶解平衡可以表示为 BaCO3(s)?Ba2++CO32-
①写出平衡常数表达式
②用重量法测定空气中CO2的体积分数时,选用Ba(OH)2而不是Ca(OH)2为沉淀剂,原因之一是:25℃时,BaCO3的溶解平衡常数K=2.58×10-9,而CaCO3的溶解平衡常数K=4.96×10-9;原因之二是
(5)某同学很快就判断出以下中长石风化的离子方程式未配平:
4Na0.5Ca0.5Al1.5Si2.5O6+6CO2+17H2O→2Na++2Ca2++5HCO3-+4H4SiO4+3Al2SiO5(OH)4
该同学判断的角度是
(6)甲醇可制成新型燃料电池,总反应为:2CH3OH+3O2+4KOH→2K2CO3+6H2O该电池负极的电极反应式为:CH3OH-6e+8OH-→CO32-+6H2O则正极的电极反应式为:
考点:物质分离和提纯的方法和基本操作综合应用,化学电源新型电池,难溶电解质的溶解平衡及沉淀转化的本质,制备实验方案的设计
专题:实验设计题,基本概念与基本理论
分析:(1)碳酸氢钾不稳定,加热时分解生成碳酸钾和二氧化碳、水,碳酸钾不分解;
(2)4.4kgCO2的物质的量是100mol,100mol二氧化碳和足量氢气反应放出4947KJ热量,据此计算1mol二氧化碳与足量氢气反应放出的热量,从而写出其热化学反应方程式;根据合成甲醇的方程可知,反应生成甲醇和水蒸气,水蒸气可以给碳酸氢钾分解提供能量;
(3)合成甲醇的反应为体积减小的反应,增大压强平衡正移;
(4)①溶解平衡方程式书写平衡常数表达式;
②重量法测定空气中CO2的体积分数,要求称量准确,误差小;
(5)书写离子方程式要注意原子守恒和电荷守恒;
(6)碱性甲醇燃料电池中,甲醇在负极失电子,氧气在正极得电子.
(2)4.4kgCO2的物质的量是100mol,100mol二氧化碳和足量氢气反应放出4947KJ热量,据此计算1mol二氧化碳与足量氢气反应放出的热量,从而写出其热化学反应方程式;根据合成甲醇的方程可知,反应生成甲醇和水蒸气,水蒸气可以给碳酸氢钾分解提供能量;
(3)合成甲醇的反应为体积减小的反应,增大压强平衡正移;
(4)①溶解平衡方程式书写平衡常数表达式;
②重量法测定空气中CO2的体积分数,要求称量准确,误差小;
(5)书写离子方程式要注意原子守恒和电荷守恒;
(6)碱性甲醇燃料电池中,甲醇在负极失电子,氧气在正极得电子.
解答:
解:(1)在整个生产过程中饱和K2CO3溶液的作用是富集二氧化碳,二氧化碳和饱和的碳酸钾溶液反应生成碳酸氢钾,碳酸氢钾不稳定,加热时分解生成碳酸钾、二氧化碳和水,KOH溶液与二氧化碳是碳酸钾,K2CO3难分解产生CO2,
故答案为:富集CO2;生成的K2CO3难分解产生CO2;
(2)44gCO2的物质的量是1mol,1mol二氧化碳和足量氢气反应放出49.5KJ热量,所以其热化学反应方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.5KJ/mol;根据合成甲醇的方程可知,反应生成甲醇和水蒸气,水蒸气可以给碳酸氢钾分解提供能量,所以转化过程中可循环利用的物质除了K2CO3外,还有水蒸气;
故答案为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.5KJ/mol;水蒸气;
(3)合成甲醇的反应为体积减小的反应,增大压强平衡正移,有利于提高反应速率和原料利用率,但是压强太高对反应的设备要求很高,又提高了生产成本,所以不能太高;
故答案为:适当加压有利于提高反应速率和原料利用率,但压强太高增大成本;
4)①BaCO3的溶解平衡可以表示为 BaCO3(s)?Ba2++CO32-,平衡常数表达式为K= c(Ba2+)c(CO32-),故答案为:K= c(Ba2+)c(CO32-);
②重量法测定空气中CO2的体积分数,要求称量准确,误差小,BaCO3的式量大,称量的相对误差小,故答案为:BaCO3的式量大,相对误差小;
(5)书写离子方程式要注意原子守恒和电荷守恒,4Na0.5Ca0.5Al1.5Si2.5O6+6CO2+17H2O→2Na++2Ca2++5HCO3-+4H4SiO4+3Al2SiO5(OH)4中电荷不守恒,所以离子方程式错误,
故答案为:未配平两边电荷数;
(6)碱性甲醇燃料电池中,甲醇在负极失电子,氧气在正极得电子生成氢氧根离子,则正极反应式为:O2+2H2O+4e→4OH-;
故答案为:O2+2H2O+4e→4OH-.
故答案为:富集CO2;生成的K2CO3难分解产生CO2;
(2)44gCO2的物质的量是1mol,1mol二氧化碳和足量氢气反应放出49.5KJ热量,所以其热化学反应方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.5KJ/mol;根据合成甲醇的方程可知,反应生成甲醇和水蒸气,水蒸气可以给碳酸氢钾分解提供能量,所以转化过程中可循环利用的物质除了K2CO3外,还有水蒸气;
故答案为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.5KJ/mol;水蒸气;
(3)合成甲醇的反应为体积减小的反应,增大压强平衡正移,有利于提高反应速率和原料利用率,但是压强太高对反应的设备要求很高,又提高了生产成本,所以不能太高;
故答案为:适当加压有利于提高反应速率和原料利用率,但压强太高增大成本;
4)①BaCO3的溶解平衡可以表示为 BaCO3(s)?Ba2++CO32-,平衡常数表达式为K= c(Ba2+)c(CO32-),故答案为:K= c(Ba2+)c(CO32-);
②重量法测定空气中CO2的体积分数,要求称量准确,误差小,BaCO3的式量大,称量的相对误差小,故答案为:BaCO3的式量大,相对误差小;
(5)书写离子方程式要注意原子守恒和电荷守恒,4Na0.5Ca0.5Al1.5Si2.5O6+6CO2+17H2O→2Na++2Ca2++5HCO3-+4H4SiO4+3Al2SiO5(OH)4中电荷不守恒,所以离子方程式错误,
故答案为:未配平两边电荷数;
(6)碱性甲醇燃料电池中,甲醇在负极失电子,氧气在正极得电子生成氢氧根离子,则正极反应式为:O2+2H2O+4e→4OH-;
故答案为:O2+2H2O+4e→4OH-.
点评:本题考查了化学平衡移动的影响因素、热化学反应方程式的书写、电极反应式的书写、溶解平衡等知识点,题目难度中等,注意燃料电池中电极反应式的书写要结合电解质溶液的酸碱性.

练习册系列答案
相关题目
将铜纳米颗粒和银纳米颗粒相隔一定距离固定在石墨片上,然后浸在AgNO3溶液中,可构成一种纳米型原电池.该电池负极发生的反应为( )
| A、Ag++e-═Ag |
| B、Cu-2e-═Cu2+ |
| C、Cu2++2e-═Cu |
| D、2H++2e-═H2↑ |
相对原子质量原来以16O原子质量的十六分之一为标准,以该标准得到的仍为整数的是( )
| A、14N的质量数 |
| B、碳原子的相对质量 |
| C、氯元素的相对原子质量 |
| D、氢氧化钠的摩尔质量 |

 +N2↑+3CO2↑
+N2↑+3CO2↑