题目内容
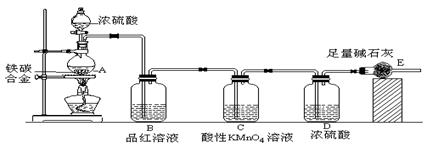
(5分)某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出):

请回答下列问题:
(1)加热过程中,观察到A容器中出现大量白色烟雾,随着反应的进行,底部有白色沉淀生成,该沉淀物是________。
(2)对A容器中的浓H2SO4和铜片进行加热,很快发现C容器中品红溶液褪色,但始终未见D容器中澄清石灰水出现浑浊或沉淀。你的猜想是_______。设计实验验证你的猜想_____________。

请回答下列问题:
(1)加热过程中,观察到A容器中出现大量白色烟雾,随着反应的进行,底部有白色沉淀生成,该沉淀物是________。
(2)对A容器中的浓H2SO4和铜片进行加热,很快发现C容器中品红溶液褪色,但始终未见D容器中澄清石灰水出现浑浊或沉淀。你的猜想是_______。设计实验验证你的猜想_____________。
(共6分)(1)CuSO4 (1分)
(2)SO2溶解度较大,澄清石灰水中Ca(OH)2含量低,生成了Ca(HSO3)2溶液(2分。) 取样后,向其中加入氢氧化钠溶液,观察是否有沉淀生成(或者加盐酸检验SO2气体等方法)(2分。试剂或操作1分,现象描述1分)
(2)SO2溶解度较大,澄清石灰水中Ca(OH)2含量低,生成了Ca(HSO3)2溶液(2分。) 取样后,向其中加入氢氧化钠溶液,观察是否有沉淀生成(或者加盐酸检验SO2气体等方法)(2分。试剂或操作1分,现象描述1分)
试题分析:(1)铜和浓硫酸反应生成硫酸铜,加热的情况下,由于A容器中出现大量白色烟雾,导致溶剂减少,且浓硫酸具有吸水性,所以会析出白色固体硫酸铜。
(2)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,说明产生SO2气体的速率快,但始终未见D试管中澄清石灰水出现浑浊或沉淀,这是由于SO2溶解度较大,立即生成了Ca(HSO3)2溶液的缘故。因此验证猜想的方法是取样后,向其中加入氢氧化钠溶液,观察是否有沉淀生成(或者加热、加盐酸检验SO2气体等方法)。
点评:化学是一门以实验为基础的学科,所以有化学实验即科学探究之说法。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目




 2Fe+3CO
2Fe+3CO ,此反应可用于工业上冶炼金属铁。反应中,作为氧化剂的物质是________(填化学式)。在该反应中,若消耗了1 mol
,此反应可用于工业上冶炼金属铁。反应中,作为氧化剂的物质是________(填化学式)。在该反应中,若消耗了1 mol  ,则转移了_____mol电子,生成的CO
,则转移了_____mol电子,生成的CO