题目内容
2.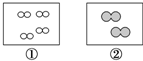 如图所示,①和②为两个体积相同的固定容器,图中“○”和“●”分别表示氢原子和氧原子,则下列说法正确的是( )
如图所示,①和②为两个体积相同的固定容器,图中“○”和“●”分别表示氢原子和氧原子,则下列说法正确的是( )| A. | 若①中的H2为1 mol,则②中所含原子总数为3.01×1023个 | |
| B. | ①和②中气体的质量之比为1:8 | |
| C. | H2、O2均能发生化合反应,但不能发生置换反应 | |
| D. | 两容器的温度和压强均相同 |
分析 A.若①中的H2为1 mol,则②中所含氧气分子为0.5mol;
B.气体分子数之比等于其物质的量之比,结合摩尔质量计算质量之比;
C.氢气还原氧化铜发生置换反应,氧气氧化硫化氢生成单质硫发生置换反应;
D.①和②为两个体积相同的固定容器,但分子个数不同,所以温度和压强不可能均相同;
解答 解:A.若①中的H2为1 mol,则②中所含氧气分子为0.5mol,原子总数为6.02×1023个,故A错误;
B.若①中的H2为1 mol,则②中所含氧气分子为0.5mol,①和②中气体的质量之比为1×2:0.5×32=1:8,故B正确;
C.氢气还原氧化铜发生置换反应,H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,氧气氧化硫化氢生成单质硫发生置换反应,O2+2H2S=2S+2H2O,H2、O2均能发生化合反应,都能发生置换反应,故C错误;
D.两容器的体积相同,但分子个数不同,所以两容器的温度和压强不可能均相同,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常定律、气体物质的量和微粒数、质量的计算分析判断,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
10.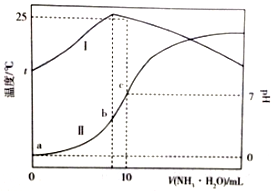 温度为t℃时,在10mL1.0mol/L的盐酸中,逐滴滴入xmol/L的氨水,随着氨水遂渐加入,溶液中的温度变化曲线(曲线I)和pH变化曲线(曲线II)如图所示(忽略混合时溶液体积的变化).下列有关判断正确的是( )
温度为t℃时,在10mL1.0mol/L的盐酸中,逐滴滴入xmol/L的氨水,随着氨水遂渐加入,溶液中的温度变化曲线(曲线I)和pH变化曲线(曲线II)如图所示(忽略混合时溶液体积的变化).下列有关判断正确的是( )
 温度为t℃时,在10mL1.0mol/L的盐酸中,逐滴滴入xmol/L的氨水,随着氨水遂渐加入,溶液中的温度变化曲线(曲线I)和pH变化曲线(曲线II)如图所示(忽略混合时溶液体积的变化).下列有关判断正确的是( )
温度为t℃时,在10mL1.0mol/L的盐酸中,逐滴滴入xmol/L的氨水,随着氨水遂渐加入,溶液中的温度变化曲线(曲线I)和pH变化曲线(曲线II)如图所示(忽略混合时溶液体积的变化).下列有关判断正确的是( )| A. | c点时,c(NH3•H2O)=1.0mol•L-1 | B. | a点时,水的电离程度最大 | ||
| C. | b点时,c(NH4+)>c(Cl-)>c(H+)>c(OH-) | D. | c点时,c(NH3•H2O)=$\frac{x-1}{2}$mol•L-1 |
17.下列物质中,属于强电解质的是( )
| A. | NH3•H2O | B. | H2O | C. | KOH | D. | CH3COOH |
7.下列化学用语表达不正确的是( )
| A. | 乙烯的最简式:CH2 | B. | S2-的结构示意图: | ||
| C. | NH3的结构式: | D. | HCl的电子式: |
14.反应2Mg+CO2 $\frac{\underline{\;点燃\;}}{\;}$ 2MgO+C,故干冰不可用扑灭于镁条引起的火灾.该反应属于( )
| A. | 化合反应 | B. | 复分解反应 | C. | 置换反应 | D. | 分解反应 |
11.在标准状况下,若V LNH3中含有的氢原子个数为n,则阿伏加德罗常数可表示为( )
| A. | $\frac{vn}{22.4}$ | B. | $\frac{22.4n}{v}$ | C. | $\frac{vn}{5.6}$ | D. | $\frac{22.4n}{3v}$ |
 ,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变得与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.
,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变得与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.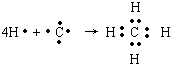 .
.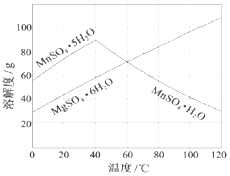 软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2=MnSO4
软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2=MnSO4