题目内容
有三种质量比可能相同或不同的镁铝合金样品①、②、③.小明、小青、小红三同学各取一种样品,对合金中镁的质量分数进行下列实验探究.
(1)小明取样品①m1g和过量的氢氧化钠溶液反应,然后过滤;再往滤液中通入过量的二氧化碳气体,发生的反应为[Al(OH)4]-+CO2+H2O═Al(OH)3↓+HCO3- 将所得沉淀过滤、洗涤、烘干、灼烧,得到固体质量仍为m1g.则合金中镁的质量分数为 .
(2)小青取样品②m2g和足量的稀硫酸反应,发现固体完全溶解,标准状况下得到气体体积为V L,则m2的取值范围是 .
(3)小红取不同质量的样品③分别和30mL同浓度的盐酸反应,所取合金质量与产生气体体积(标准状况下测定)如下表所示:
求:(ⅰ)盐酸的物质的量浓度;
(ⅱ)合金中镁的质量分数;
(ⅲ)在c组实验后,还需向容器中加入1.0mol/L的氢氧化钠溶液多少毫升才能使剩余合金中的铝恰好完全溶解? .
(1)小明取样品①m1g和过量的氢氧化钠溶液反应,然后过滤;再往滤液中通入过量的二氧化碳气体,发生的反应为[Al(OH)4]-+CO2+H2O═Al(OH)3↓+HCO3- 将所得沉淀过滤、洗涤、烘干、灼烧,得到固体质量仍为m1g.则合金中镁的质量分数为
(2)小青取样品②m2g和足量的稀硫酸反应,发现固体完全溶解,标准状况下得到气体体积为V L,则m2的取值范围是
(3)小红取不同质量的样品③分别和30mL同浓度的盐酸反应,所取合金质量与产生气体体积(标准状况下测定)如下表所示:
| 实验序号 | a | b | c |
| 合金质量(mg) | 510 | 765 | 918 |
| 气体体积(mL) | 560 | 672 | 672 |
(ⅱ)合金中镁的质量分数;
(ⅲ)在c组实验后,还需向容器中加入1.0mol/L的氢氧化钠溶液多少毫升才能使剩余合金中的铝恰好完全溶解?
考点:探究物质的组成或测量物质的含量,常见金属元素的单质及其化合物的综合应用
专题:几种重要的金属及其化合物
分析:(1)发生的反应为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑、NaAlO2+CO2+2H2O=NaHCO3+Al(OH)3↓、2Al(OH)3
Al2O3+3H2O,得到的固体是氧化铝,反应前后质量不变,说明氧化铝中的氧元素质量分数等于镁元素质量分数;
(2)采用极限法计算固体质量范围;
(3)(i)先判断盐酸是否完全反应,若盐酸完全反应,根据氢气求出消耗的盐酸,再求出浓度;
(ii)根据表中数据可知,a组中金属完全反应,根据金属的总质量和生成氢气的物质的量列方程组,计算;
(iii)根据方程式中转化关系以及原子守恒计算.
| ||
(2)采用极限法计算固体质量范围;
(3)(i)先判断盐酸是否完全反应,若盐酸完全反应,根据氢气求出消耗的盐酸,再求出浓度;
(ii)根据表中数据可知,a组中金属完全反应,根据金属的总质量和生成氢气的物质的量列方程组,计算;
(iii)根据方程式中转化关系以及原子守恒计算.
解答:
解:(1)发生的反应为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑、NaAlO2+CO2+2H2O=NaHCO3+Al(OH)3↓、2Al(OH)3
Al2O3+3H2O,得到的固体是氧化铝,反应前后质量不变,说明氧化铝中的氧元素质量分数等于镁元素质量分数,则合金中镁元素的质量分数=
×100%=47.06%,
故答案为:47.06%;
(2)假设全部是Mg,设镁的质量为x,
Mg+2H+=Mg2++H2 ↑
24g 22.4L
x VL
=
x=1.07V;
假设合金全部是Al,
设铝的质量是y,
2Al+6H+=2Al2++3H2↑
54g 67.2L
yg VL
=
,
y=0.80V,
因为是两种金属的合金,所以0.80V<m<1.07V;
故答案为:0.80V<m<1.07V;
(3)(i)bc中生成的气体体积相同,c中金属的质量较大,则c中盐酸反应完全,n(H2)=0.672/22.4=0.03 mol,
则c(HCl)=
=2.0 mol?L-1,
故答案为:2.0 mol?L-1;
(ii)设合金中Mg、Al的物质的量分别为xmol、ymol,则有:
24x+27y=0.510g
x+
y=
解得:x=y=0.01 mol;
则w(Mg)=
×100%=47.06%;
故答案为:47.06%;
(iii)盐酸最终转化为NaCl,Al转化为NaAlO2,则由HCl~NaCl和Al~NaAlO2可知
n(NaCl)=n(HCl)=2.0 mol?L-1×0.030 L=0.06 mol;
n(NaAlO2)=n(Al)=0.01 mol×918/510=0.018 mol;
根据Na+守恒得:n(NaOH)=0.06 mol+0.018 mol=0.078 mol;
故V(NaOH)=0.078 mol/1.0 mol?L-1=0.078 L=78 mL;
故答案为:78ml.
| ||
| 16×3 |
| 16×3+27×2 |
故答案为:47.06%;
(2)假设全部是Mg,设镁的质量为x,
Mg+2H+=Mg2++H2 ↑
24g 22.4L
x VL
| 24g |
| xg |
| 22.4L |
| VL |
x=1.07V;
假设合金全部是Al,
设铝的质量是y,
2Al+6H+=2Al2++3H2↑
54g 67.2L
yg VL
| 54g |
| yg |
| 67.2L |
| VL |
y=0.80V,
因为是两种金属的合金,所以0.80V<m<1.07V;
故答案为:0.80V<m<1.07V;
(3)(i)bc中生成的气体体积相同,c中金属的质量较大,则c中盐酸反应完全,n(H2)=0.672/22.4=0.03 mol,
则c(HCl)=
| 0.03mol×2 |
| 0.03L |
故答案为:2.0 mol?L-1;
(ii)设合金中Mg、Al的物质的量分别为xmol、ymol,则有:
24x+27y=0.510g
x+
| 3 |
| 2 |
| 0.560L |
| 22.4L/mol |
解得:x=y=0.01 mol;
则w(Mg)=
| 0.01mol×24g/mol |
| 0.510g |
故答案为:47.06%;
(iii)盐酸最终转化为NaCl,Al转化为NaAlO2,则由HCl~NaCl和Al~NaAlO2可知
n(NaCl)=n(HCl)=2.0 mol?L-1×0.030 L=0.06 mol;
n(NaAlO2)=n(Al)=0.01 mol×918/510=0.018 mol;
根据Na+守恒得:n(NaOH)=0.06 mol+0.018 mol=0.078 mol;
故V(NaOH)=0.078 mol/1.0 mol?L-1=0.078 L=78 mL;
故答案为:78ml.
点评:本题考查了合金的有关计算,明确物质之间的反应结合方程式来分析解答,注意根据反应方程式及结合原子守恒进行计算,题目难度较大.

练习册系列答案
相关题目
下列反应属于吸热反应的是( )
| A、铜与硫蒸气反应 |
| B、Mg粉与水反应 |
| C、干冰升华为气体 |
| D、硫酸钙高温锻烧 |
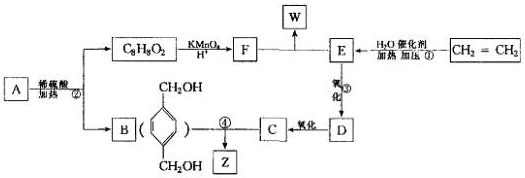
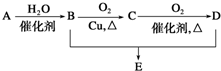 有机物A的产量是衡量一个国家石油工业发展水平的标志,可发生以下系列转化,B、D是生活中常见的两种有机物,下列说法不正确的是( )
有机物A的产量是衡量一个国家石油工业发展水平的标志,可发生以下系列转化,B、D是生活中常见的两种有机物,下列说法不正确的是( )| A、A的结构简式为CH2=CH2 |
| B、1molB物质可以与足量Na反应生成0.5molH2 |
| C、B、D、E三种物质可以用饱和Na2CO3溶液鉴别 |
| D、由B、D制备E浓H2SO4只作吸水剂 |
 )是其中的一种,它可以从茉莉花中提取.一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取.一种合成路线如下: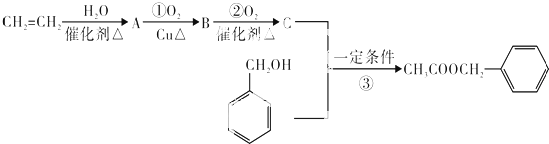
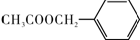 )的说法正确的是
)的说法正确的是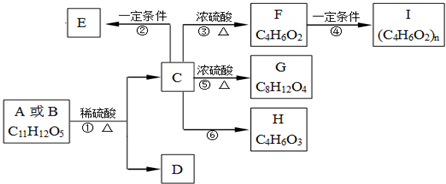
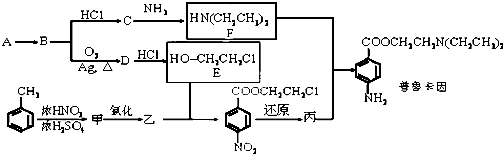
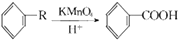 ,从A出发发生图示中的一系列反应,其中B和C按1:2反应生成Z,F和E按1:2反应生成W,W和Z互为同分异构体.
,从A出发发生图示中的一系列反应,其中B和C按1:2反应生成Z,F和E按1:2反应生成W,W和Z互为同分异构体.