题目内容
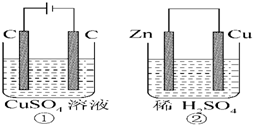 如图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.2mol?L-1,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中错误的是( )
如图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.2mol?L-1,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中错误的是( )| A、电极反应式:①中阳极:4OH--4e-═2H2O+O2↑ ②中正极:2H++2e-═H2↑ |
| B、①中溶液的pH和②中溶液的PH相同 |
| C、①中SO42-向阳极移动,②中SO42-向铜片附近移动 |
| D、两个装置中产生的气体的体积之比为1:2 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:①有外接电源,所以是电解池,阳极发生4OH--4e-=2H2O+O2↑,阴极反应为:Cu2++2e-=Cu;
②为原电池,正极反应为2H++2e-=H2↑,负极反应为Zn-2e-=Zn2+,以此解答该题.
②为原电池,正极反应为2H++2e-=H2↑,负极反应为Zn-2e-=Zn2+,以此解答该题.
解答:
解:溶液的体积均为200mL,开始时电解质溶液的浓度均为0.2mol?L-1,工作一段时间后,测得导线中均通过0.02mol电子,①有外接电源,所以是电解池,阳极发生4OH--4e-=2H2O+O2↑,阴极反应为:Cu2++2e-=Cu;②为原电池,正极反应为2H++2e-=H2↑,负极反应为Zn-2e-=Zn2+,
A.电极反应式:①中阳极:4OH--4e-═2H2O+O2↑ ②中正极:2H++2e-═H2↑,故A正确;
B.当线路中通过0.02 mol电子后,①中OH-放电生成0.02molH+,②中有H+放电消耗0.02molH+,最终两个装置中c(H+)相同,都等于0.1mol/L,故B正确;
C.在原电池中阴离子向负极移动,则②中SO42-向锌片附近移动,在电解池中阴离子向阳极移动,则①中SO42-向阳极移动,故C错误;
D.导线中均通过0.02mol电子,①中阳极:4OH--4e-═2H2O+O2↑,则产生的气体0.005 mol,②中正极:2H++2e-═H2↑,则产生的气体为0.01 mol,所以体积比为1:2,故D正确.
故选C.
A.电极反应式:①中阳极:4OH--4e-═2H2O+O2↑ ②中正极:2H++2e-═H2↑,故A正确;
B.当线路中通过0.02 mol电子后,①中OH-放电生成0.02molH+,②中有H+放电消耗0.02molH+,最终两个装置中c(H+)相同,都等于0.1mol/L,故B正确;
C.在原电池中阴离子向负极移动,则②中SO42-向锌片附近移动,在电解池中阴离子向阳极移动,则①中SO42-向阳极移动,故C错误;
D.导线中均通过0.02mol电子,①中阳极:4OH--4e-═2H2O+O2↑,则产生的气体0.005 mol,②中正极:2H++2e-═H2↑,则产生的气体为0.01 mol,所以体积比为1:2,故D正确.
故选C.
点评:本题考查原电池和电解池的工作原理,注意把握电极方程式的书写和电荷守恒的应用,为解答该题的关键,注意原电池和电解池的区别,题目难度不大

练习册系列答案
相关题目
下列说法正确的是( )
| A、进行纸层析操作时,要让层析试纸上的点样点进入展开剂,进行展开 |
| B、在酸性K2Cr2O7溶液中滴加亚硝酸钠溶液,溶液会变绿色 |
| C、乙酸和乙醇的混合液可用分夜漏斗进行分离 |
| D、用盐酸标准液滴定待测的氢氧化钠时,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低 |
萃取水中的溴,不可以选择的萃取剂是( )
| A、汽油 | B、酒精 | C、苯 | D、四氯化碳 |
下列叙述正确的是( )
| A、石油裂化主要得到乙烯 |
| B、石油分馏是化学变化,可得到汽油、煤油等 |
| C、煤的干馏主要得到煤焦油、焦炉气、焦炭、粗氨水 |
| D、煤的气化和液化是物理变化,是使煤变成清洁能源的有效途径 |
下列关于油脂的叙述不正确的是( )
| A、油脂属于酯类,是高级脂肪酸的甘油酯 |
| B、油脂没有固定的熔、沸点 |
| C、油脂在不同条件下水解都能生成甘油 |
| D、油脂都不能使溴水褪色 |
若NA表示阿佛加德罗常数,下列说法正确的是( )
| A、1molCH3COONa溶液中CH3COO-个数为NA |
| B、标况下,22.4L氢气中含有NA个氢原子 |
| C、NA个一氧化碳分子和0.5mol 甲烷的质量比为7:4 |
| D、14gN2中含有7NA个电子 |
要配制浓度约为2mol?L-1NaOH溶液100mL,下面操作正确的是( )
| A、称取8gNaOH固体,放入100mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解 |
| B、称取8gNaOH固体,放入100mL量筒中,边搅拌,便慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL |
| C、称取8gNaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加水到刻度,盖好瓶塞,反复摇匀 |
| D、用100mL量筒量取40mL5mol?L-1NaOH溶液,倒入250mL烧杯中,再用同一量筒取60mL蒸馏水,不断搅拌下,慢慢倒入烧杯 |
阿伏加德罗常数约为6.02×1023mol-1,下列说法正确的是( )
| A、1.0L1mol/L氨水中,NH3?H2O的分子数为6.02×1023 |
| B、白磷分子(P4)呈正四面体结构,31g 白磷中含有P-P键个数为6×6.02×1023 |
| C、1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
| D、20g 重水(2H216O)中含有的中子数为8×6.02×1023 |
有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同.下列各项事实不能说明上述观点的是( )
| A、乙酸分子中羟基上的氢原子较乙醇中羟基上的氢原子更活泼 |
| B、乙烯能发生加成反应,而乙烷不能发生加成反应 |
| C、甲苯的硝化反应较苯更容易 |
| D、苯酚能和氢氧化钠溶液反应,而乙醇不能和氢氧化钠溶液反应 |