题目内容
5.碳与非金属R能形成化合物CRx,CRx中原子的最外层电子数之和为16,核外电子总数为38.判断CRx的化学式为CS2.分析 C的原子序数为6,最外层电子数为4,CRx中原子的最外层电子数之和为16,则x个R的核外最外层电子数共为12,核外电子总数为38,可知x个R的电子数共为32,可讨论x的值来解答该题.
解答 解:C的原子序数为6,最外层电子数为4,CRx中原子的最外层电子数之和为16,则x个R的核外最外层电子数共为12,核外电子总数为38,可知x个R的电子数共为32,
如x=1,为Ge,不符合;
如x=2,R的原子序数为16,最外层为6个电子,与2个R的核外最外层电子数共为12相吻合,符合;
如x=3,不符合;
如x=4,R的原子序数为8,最外层电子数为6,与4个R的核外最外层电子数共为12相矛盾,不符合.
则CRx的化学式为CS2,
故答案为:CS2.
点评 本题考查原子与元素周期率知识,为高频考点,侧重考查学生的分析能力,注意把握原子核外电子排布的特点,难度不大.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
15.能够证明某卤代烃中存在氯元素的操作及现象是( )
| A. | 在卤代烃中直接加入稀硝酸酸化的AgNO3溶液,产生白色沉淀 | |
| B. | 加入NaOH的乙醇溶液,加热后加入AgNO3溶液,产生白色沉淀 | |
| C. | 加蒸馏水,充分搅拌后,加入AgNO3溶液,产生白色沉淀 | |
| D. | 加入NaOH溶液,加热一段时间后冷却,加入稀硝酸酸化,然后加入AgNO3溶液,产生白色沉淀 |
16.多年来世界发达国家的科研和生产实践已证明氢能是摆脱对石油依赖的最经济有效的能源,有关专家甚至认为氢能将是主宰未来世界的主要能源.目前有人研究出将淀粉或纤维素、水在酶作用下转变为二氧化碳和氢气的方法来制取氢气.下列说法错误的是( )
| A. | 上述制氢气的反应式可表示为:(C6H10O5)n+7nH2O$\stackrel{酶}{→}$6nCO2↑+12nH2↑ | |
| B. | 从整个能量循环来看,利用该方法得到的氢能来源于光能 | |
| C. | 酶作为催化剂需要合适的温度 | |
| D. | 氢元素有3种核素,形成的H2分子有3种 |
13.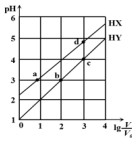 在浓度均为0.1mol/L、体积均为V0的HX、HY,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化关系如图所示.下列叙述正确的是( )
在浓度均为0.1mol/L、体积均为V0的HX、HY,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化关系如图所示.下列叙述正确的是( )
 在浓度均为0.1mol/L、体积均为V0的HX、HY,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化关系如图所示.下列叙述正确的是( )
在浓度均为0.1mol/L、体积均为V0的HX、HY,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化关系如图所示.下列叙述正确的是( )| A. | a、b两点的溶液中:c(X-)>c(Y-) | |
| B. | 相同温度下,电离常数K(HX):d>a | |
| C. | 溶液中水的电离程度:d>c>b>a | |
| D. | lg$\frac{V}{{V}_{0}}$=2时,若同时微热两种液体(不考虑HX、HY和H2O的挥发),则$\frac{c({X}^{-})}{c({Y}^{-})}$ 增大 |
20.乙酰水杨酸是一种常见的解热镇痛药,结构简式如图所示.下列有关叙述正确的是( )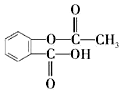

| A. | 乙酰水杨酸的分子式为C9H10O4 | |
| B. | 1mol乙酰水杨酸能与5molH2发生加成反应 | |
| C. | 1mol乙酰水杨酸在NaOH溶液中能与3mol NaOH反应 | |
| D. | 用烃基(-C4H9)取代乙酰水杨酸苯环上的氢原子,最多能形成4种同分异构体 |
10.下列实验操作正确的是( )
| A. | 用容量瓶配制溶液时,先用蒸馏水洗涤,再用待装溶液润洗 | |
| B. | 用湿润的红色石蕊试纸检验酸性气体 | |
| C. | 用烧杯加热分解Al(OH)3固体 | |
| D. | 用分液漏斗分离乙酸乙酯和饱和碳酸钠溶液 |
19.下列物质属于电解质的是( )
| A. | 次氯酸 | B. | 细铁丝 | C. | 氯水 | D. | 干冰 |
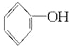 +2Na→2
+2Na→2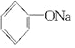 +H2↑
+H2↑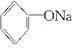 +H2O.
+H2O.