题目内容
已知实验室制氯气的化学方程式为:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O,其中
MnCl2+Cl2↑+2H2O,其中
(1) MnO2中Mn元素被_____________。(填“氧化”或“还原”)
(2) HCI中氯原子___________(填“得到”或“失去”)电子。
(3)反应中还原剂与氧化剂的物质的量之比为______________。
(4)标出此反应中电子转移情况:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
【答案】
(6分)(1)还原(1分) (2)失去(1分) (3)2:1 (2分)
(4) (2分)
(2分)
【解析】
试题分析:(1)根据反应方程式可知,二氧化锰中Mn元素的化合价从+4价降低到+2价,被还原。
(2)氯化氢中氯元素的化合价从-1价升高到0价,因此失去电子。
(3)1mol氧化剂二氧化锰得到2mol电子,1mol还原剂氯化氢失去1mol电子,因此反应中还原剂与氧化剂的物质的量之比为2:1。
(4)反应中氯化氢是还原剂,二氧化锰是氧化剂,转移2mol电子,因此电子转移情况为 。
。
考点:考查氧化还原反应的有关判断和计算

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
 (4)可用下图实验装置精制粗溴。
(4)可用下图实验装置精制粗溴。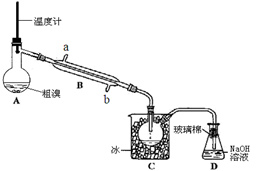
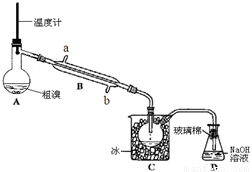
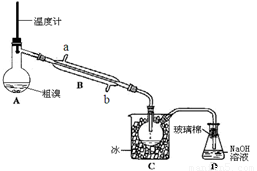
 ①反应过程中需要对A容器加热,加热的方法是
。
①反应过程中需要对A容器加热,加热的方法是
。