题目内容
n g CO2中有m个O原子,则阿伏加德罗常数NA的数值可表示为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
考点:阿伏加德罗常数
专题:计算题
分析:先根据n=
计算出ngCO2的物质的量,再根据二氧化碳的分子组成计算出氧气的物质的量,然后再根据N=nNA计算出阿伏伽德罗即可.
| n |
| M |
解答:
解:ng二氧化碳的物质的量为:n(CO2)=
=
mol,ng二氧化碳中含有氧原子的物质的量为:n(O)=
mol×2=
mol,根据N=nNA可知NA=
=
=
,
故选A.
| ng |
| 44g/mol |
| n |
| 44 |
| n |
| 44 |
| n |
| 22 |
| N |
| n |
| m | ||
|
| 22m |
| n |
故选A.
点评:本题考查阿伏加德罗常数的有关计算,题目难度不大,注意明确阿伏伽德罗常数的概念及表达式,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,还要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.

练习册系列答案
相关题目
下列说法正确的是( )
| A、常温下,反应2A (s)+B (g)=2C (g)+D (g)不能自发进行,则该反应△H一定大于0 |
| B、铅蓄电池在放电过程中,负极质量增加,正极质量减少 |
| C、其他条件不变,向纯水中加入盐酸或氢氧化钠都能抑制水的电离,降低水的离子积 |
| D、常温下,向饱和碳酸钠溶液中加入过量碳酸钡粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,则常温下Ksp(BaCO3)<Ksp(BaSO4) |
 如图
如图 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述不正确的是( )
后,使c、d两点短路.下列叙述不正确的是( )| A、a为直流电源的正极 |
| B、c极发生的反应为2H++2e-=H2↑ |
| C、f电极为锌板 |
| D、e极发生氧化反应 |
下列叙述正确的是( )
①久置于空气中的氢氧化钠溶液,加足量盐酸时有气体产生
②若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q
③SiO2和CO2都是酸性氧化物,都能与强碱溶液反应,但不能与任何酸反应
④玻璃、水泥、水晶项链都是硅酸盐制品
⑤液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
⑥氢氧化铁胶体与氯化铁溶液分别蒸干灼烧得相同的物质.
①久置于空气中的氢氧化钠溶液,加足量盐酸时有气体产生
②若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q
③SiO2和CO2都是酸性氧化物,都能与强碱溶液反应,但不能与任何酸反应
④玻璃、水泥、水晶项链都是硅酸盐制品
⑤液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
⑥氢氧化铁胶体与氯化铁溶液分别蒸干灼烧得相同的物质.
| A、①⑥ | B、①④⑥ |
| C、②③④ | D、④⑤⑥ |
同温同压下,1molHe和1molH2具有相同的( )
| A、原子数 | B、质量 |
| C、中子数 | D、体积 |
某无色溶液能与铝作用生成氢气,则溶液中可能大量共存的离子组是( )
| A、H+、Ba2+、Mg2+、NO3- |
| B、Cl-、CO32-、Cu2+、Mg2+ |
| C、NO3-、SO42-、K+、OH- |
| D、NO3-、HCO3-、Ba2+、Cl- |
一学生欲通过实验判断X,Y,Z,W四块金属的活泼性,做了如下实验并得结论:当X,Y与稀硫酸组成原电池时,Y为负极; Z可以从水中置换出H2,W不能从水中置换出H2;W能将Y从其盐溶液中置换出来,据此可知它们的活泼性顺序是( )
| A、Z>X>W>Y |
| B、Z>W>Y>X |
| C、X>Y>W>Z |
| D、X>Y>Z>W |
下列实验中,能够达到实验目的是( )
A、 实验室制取并收集氨气 |
B、 制取SO2并检验SO2的漂白性 |
C、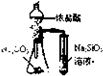 比较氯碳硅三种元素的非金属性强弱 |
D、 除去CO2中的HCl |
 已知A、B、C为中学化学中常见的单质.室温下,A为固体,B和C均为气体.在适宜的条件下,它们可以按如图进行反应.回答下列问题:
已知A、B、C为中学化学中常见的单质.室温下,A为固体,B和C均为气体.在适宜的条件下,它们可以按如图进行反应.回答下列问题: