题目内容
阅读材料,在下列表格中处理所得信息.


| 二氧化硅的应用 | 推测二氧化硅所具有的性质或写出相关方程式 |
考点:硅和二氧化硅
专题:碳族元素
分析:二氧化硅硬度大、熔点高,与普通酸不反应,可与氢氧化钠和氢氟酸反应.
解答:
解:二氧化硅硬度比玉石大;熔点高,可做坩埚;与普通酸不反应,可与氢氧化钠和氢氟酸反应,发生SiO2+2NaOH═Na2SiO3+H2O、SiO2+4HF═SiF4↑+2H2O,
故答案为:
故答案为:
| 二氧化硅的应用 | 推测二氧化硅所具有的性质或写出相关方程式 |
| 磨料,加工玉石 | 硬度大 |
| 坩埚 | 熔点高 |
| 石英坩埚不能加热氢氧化钠 | SiO2+2NaOH═Na2SiO3+H2O |
| 用氢氟酸在玻璃上雕花 | SiO2+4HF═SiF4↑+2H2O |
| 普通稀无机酸可清洗 | 化学性质较稳定 |
点评:本题考查二氧化硅的性质,难度不大,注意二氧化硅与普通酸不反应,可与氢氧化钠和氢氟酸反应.

练习册系列答案
相关题目
短周期元素W、X、Y、Z的原子序数依次增大,W、X原子的最外电子层电子数之比为4:3,Z原子比X原子的核外电子数多4.下列说法正确的是( )
| A、吸引电子能力的大小顺序一定为Z>Y>W |
| B、原子半径的大小顺序一定为X>Y>Z>W |
| C、Y、Z形成的分子的空间构型可能是正四面体 |
| D、原子核外未成对电子数可能是Z>Y>X>W |
在密闭容器中,反应X2(g)+2Y2(g)?2XY2(g)△H<0达到甲平衡,若只改变某一条件再达到乙平衡,则对此过程条件改变的分析正确的是( )
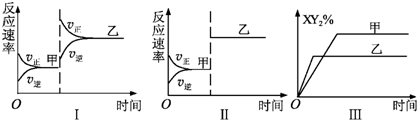

| A、图Ⅰ由甲至乙加入适当催化剂 |
| B、图Ⅱ由甲至乙扩大容器体积 |
| C、图Ⅲ由甲至乙增大压强 |
| D、图Ⅲ由甲至乙升高温度 |
下列实验装置或操作设计正确且能达到实验目的是( )
A、 配制一定物质的量浓度的稀硫酸 |
B、 制取少量的氢氧化铁胶体 |
C、 用硫酸标准溶液滴定氢氧化钠溶液 |
D、 称取氢氧化钠固体 |

 某研究性学习小组为了证明在同温同压下,相同浓度相同体积的酸性强弱不同的一元酸与足量镁带反应的速率不同,但是产生的氢气的体积相同.在如图装置中的锥形瓶中分别装入l mol.L-1的盐酸和醋酸各10mL,进行实验.
某研究性学习小组为了证明在同温同压下,相同浓度相同体积的酸性强弱不同的一元酸与足量镁带反应的速率不同,但是产生的氢气的体积相同.在如图装置中的锥形瓶中分别装入l mol.L-1的盐酸和醋酸各10mL,进行实验.