题目内容
5. 一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).T1、T2温度下甲醇物质的量随时间变化的关系如图所示,下列判断正确的是( )
一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).T1、T2温度下甲醇物质的量随时间变化的关系如图所示,下列判断正确的是( )| A. | 温度T1>温度T2 | |
| B. | 正反应为吸热反应 | |
| C. | 若平衡常数K值变大,则平衡移动时v(逆)先减小后增大 | |
| D. | 若平衡常数K值变小,平衡向正反应方向移动 |
分析 根据先拐先平数值大原则,由图可知,温度T1<T2,平衡时,温度越高CO的转化率越小,说明升高温度,平衡向逆反应移动,升高温度平衡向吸热反应移动,据此判断反应热、K1与K2关系.
解答 解:A.由图可知,温度T2先到达平衡,反应速率较快,故温度T1<T2,故A错误;
B.温度T1<T2,平衡时,温度越高CO的转化率越小,说明升高温度,平衡向逆反应移动,升高温度平衡向吸热反应移动,则正反应为放热反应,即△H<0,故B错误;
C.反应为放热反应,升高温度,平衡向逆反应移动,平衡常数变小,若平衡常数变大,则说明平衡正向进行,是降低温度,逆反应速率减小,但随平衡正向进行,生成物浓度增大,逆反应速率逐渐增大,故C正确;
D.升高温度,平衡向逆反应移动,平衡常数K值变小,故D错误,
故选C.
点评 本题考查化学平衡图象、化学平衡移动及平衡常数影响因素等,题目难度中等,注意根据先拐先平数值大原则判断温度高低,再结合CO的转化率判断反应热.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
15.原子序数为114的元素,关于它的预测正确的是( )
| A. | 该元素是非金属元素 | B. | 中子数为114 | ||
| C. | 其位置在第七周期IVA族 | D. | 质量数为114 |
16.用括号中的试剂除去下列各组中的少量杂质,最恰当的一组是( )
| A. | 苯中的苯酚(溴水) | B. | 乙醇中的水(新制的氧化钙) | ||
| C. | 苯酚中的乙酸(饱和碳酸钠溶液) | D. | 乙酸乙酯中的乙酸(乙醇) |
13.CuI是一种不溶于水的白色固体,它可由反应:2Cu2++4I-=2CuI↓+I2而得到.现用铜片、石墨作电极,电解KI溶液制取CuI.为确认反应情况,通电前在溶液中又加入了少量酚酞试液和淀粉溶液.电解一段时间后得到白色沉淀,同时阴极区溶液变红,阳极区溶液变蓝.下列说法正确的是( )
| A. | 铜片做阴极,石墨做阳极 | |
| B. | 白色沉淀在阴极附近生成 | |
| C. | 阳极区溶液变蓝的原因是:2Cu+4I--4e-═2CuI↓+I2,碘遇淀粉变蓝 | |
| D. | 阳极区溶液变蓝的原因是:4OH--4e-═2H2O+O2↑,O2将I-氧化为I2,碘遇淀粉变蓝 |
20.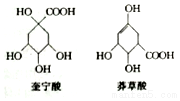 奎宁酸和莽草酸是某些高等植物特有的脂环状有机酸,常共存在一起,其结构简式如图所示.下列说法不正确的是( )
奎宁酸和莽草酸是某些高等植物特有的脂环状有机酸,常共存在一起,其结构简式如图所示.下列说法不正确的是( )
 奎宁酸和莽草酸是某些高等植物特有的脂环状有机酸,常共存在一起,其结构简式如图所示.下列说法不正确的是( )
奎宁酸和莽草酸是某些高等植物特有的脂环状有机酸,常共存在一起,其结构简式如图所示.下列说法不正确的是( )| A. | 可用高锰酸钾溶液鉴别奎宁酸和莽草酸 | |
| B. | 奎宁酸的相对分子质量比莽草酸的大16 | |
| C. | 等物质的量的奎宁酸和莽草酸分别与足量Na反应,同温同压下产生H2的体积比为5:4 | |
| D. | 等物质的量的两种分别与足量NaOH溶液反应,消耗NaOH的物质的量相同 |
10.下列分子中含手性碳原子的是( )
| A. |  | B. | CH3-CH2-CH3 | C. | CH3-CH2-CH2-OH | D. |  |
17.关于某有机物 的性质叙述不正确的是( )
的性质叙述不正确的是( )
 的性质叙述不正确的是( )
的性质叙述不正确的是( )| A. | 1 mol该有机物完全燃烧可生成12molCO2 | |
| B. | lmol该有机物分别与足量Na或NaHCO3反应,产生的气体分子数目相等 | |
| C. | 1 mol该有机物可以与5mol H2发生加成反应 | |
| D. | 1 mol该有机物可以与2 molNaOH发生反应 |
14.以下说法正确的是( )
| A. | 苏打和小苏打焰色反应的现象是相同的,说明在灼烧过程中它们发生了相同的化学变化 | |
| B. | CaCO3难溶于水,而Ca(HCO3)2易溶于水,因此NaHCO3和Na2CO3的溶解度关系为:NaHCO3>Na2CO3 | |
| C. | 将铝箔在酒精灯上加热,可观察到铝箔熔化但不掉落,原因是表面形成了高熔点的氧化膜 | |
| D. | 油条中可添加明矾,说明明矾对人体是无害的 |
15.下列电子式书写错误的是( )
| A. |  | B. |  | C. | 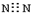 | D. |  |