题目内容
实验室用NaOH固体配制250mL 1.0mol/L的NaOH溶液,填空并请回答下列问题:
(1)应称取NaOH固体的质量 g.
(2)若实验仪器有:托盘天平、药匙、烧杯、玻璃棒 外还应有
(3)容量瓶上需标有以下五项中的 (序号);A
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(4)配制时,其正确的操作顺序是 ;
A、用30mL水洗涤烧杯2-3次,洗涤液均转入容量瓶,振荡
B、用托盘天平准确称取所需质量的NaOH,放入烧杯,加入少量水(约30mL),
用玻璃棒慢慢搅拌,使其充分溶解
C、将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D、将容量瓶盖紧,颠倒摇匀
E、改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F、继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(5)下列配制的溶液浓度偏大的是 ;
A、NaOH在烧杯中溶解后,未冷却就转移到容量瓶中
B、向容量瓶中转移溶液时,不慎有液滴洒在容量瓶外面
C、未洗涤溶解NaOH的烧杯
D、定容时俯视刻度线.
(1)应称取NaOH固体的质量
(2)若实验仪器有:托盘天平、药匙、烧杯、玻璃棒 外还应有
(3)容量瓶上需标有以下五项中的
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(4)配制时,其正确的操作顺序是
A、用30mL水洗涤烧杯2-3次,洗涤液均转入容量瓶,振荡
B、用托盘天平准确称取所需质量的NaOH,放入烧杯,加入少量水(约30mL),
用玻璃棒慢慢搅拌,使其充分溶解
C、将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D、将容量瓶盖紧,颠倒摇匀
E、改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F、继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(5)下列配制的溶液浓度偏大的是
A、NaOH在烧杯中溶解后,未冷却就转移到容量瓶中
B、向容量瓶中转移溶液时,不慎有液滴洒在容量瓶外面
C、未洗涤溶解NaOH的烧杯
D、定容时俯视刻度线.
考点:配制一定物质的量浓度的溶液
专题:实验题
分析:(1)根据n=cV和m=nM来计算;
(2)根据配制一定物质的量浓度的溶液的操作步骤选择使用的仪器;
(3)容量瓶是比较精确的仪器,不能受热,只能在一定温度下使用;
(4)根据操作过程是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶等步骤来排序;
(5)根据c=
,通过判断不当操作对溶质的物质的量n和溶液体积V的影响来分析误差.
(2)根据配制一定物质的量浓度的溶液的操作步骤选择使用的仪器;
(3)容量瓶是比较精确的仪器,不能受热,只能在一定温度下使用;
(4)根据操作过程是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶等步骤来排序;
(5)根据c=
| n |
| V |
解答:
解:(1)根据n=cV可知需要的NaOH的物质的量n=0.25L×1.0mol/L=0.25mol,质量m=nM=0.25mol×40g/mol=10.0g,故答案为:10.0;
(2)配制1mol/L的NaOH溶液250mL的操作步骤:首先计算出需要的药品的质量,然后用托盘天平(药匙)称量,后放入烧杯中溶解,同时用玻璃棒搅拌,待溶液冷却至室温后,用玻璃杯引流移液至250ml容量瓶,然后洗涤烧杯和玻璃棒2至3次,将洗涤液也注入容量瓶,然后向容量瓶中注水,至液面离刻度线1至2CM时,改用胶头滴管逐滴加入,至凹液面与刻度线相切,然后摇匀、装瓶.
用到的仪器有:托盘天平、药匙、烧杯、玻璃棒、250ml容量瓶、胶头滴管.故还需要的是250mL 容量瓶、胶头滴管,
故答案为:250mL容量瓶、胶头滴管;
(3)容量瓶是比较精确的仪器,在瓶体上标有温度和容积,在瓶颈上标有刻度线,故答案为:①③⑤;
(4)根据操作过程是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶等步骤可知正确的排序为:B、C、A、F、E、D,故答案为:B、C、A、F、E、D;
(5)A、NaOH在烧杯中溶解后,未冷却就转移到容量瓶中并定容,待溶液冷却后体积偏小,则浓度偏大,故A选;
B、向容量瓶中转移溶液时,不慎有液滴洒在容量瓶外面,会导致溶质的损失,则溶液浓度偏小,故B不选;
C、未洗涤溶解NaOH的烧杯,会导致溶质的损失,则溶液浓度偏小,故C不选;
D、定容时俯视刻度线,会导致溶液体积偏小,则浓度偏大,故D选.
故选AD.
(2)配制1mol/L的NaOH溶液250mL的操作步骤:首先计算出需要的药品的质量,然后用托盘天平(药匙)称量,后放入烧杯中溶解,同时用玻璃棒搅拌,待溶液冷却至室温后,用玻璃杯引流移液至250ml容量瓶,然后洗涤烧杯和玻璃棒2至3次,将洗涤液也注入容量瓶,然后向容量瓶中注水,至液面离刻度线1至2CM时,改用胶头滴管逐滴加入,至凹液面与刻度线相切,然后摇匀、装瓶.
用到的仪器有:托盘天平、药匙、烧杯、玻璃棒、250ml容量瓶、胶头滴管.故还需要的是250mL 容量瓶、胶头滴管,
故答案为:250mL容量瓶、胶头滴管;
(3)容量瓶是比较精确的仪器,在瓶体上标有温度和容积,在瓶颈上标有刻度线,故答案为:①③⑤;
(4)根据操作过程是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶等步骤可知正确的排序为:B、C、A、F、E、D,故答案为:B、C、A、F、E、D;
(5)A、NaOH在烧杯中溶解后,未冷却就转移到容量瓶中并定容,待溶液冷却后体积偏小,则浓度偏大,故A选;
B、向容量瓶中转移溶液时,不慎有液滴洒在容量瓶外面,会导致溶质的损失,则溶液浓度偏小,故B不选;
C、未洗涤溶解NaOH的烧杯,会导致溶质的损失,则溶液浓度偏小,故C不选;
D、定容时俯视刻度线,会导致溶液体积偏小,则浓度偏大,故D选.
故选AD.
点评:本题考查了一定物质的量浓度溶液的配制以及误差分析,难度不大,注意实验的基本操作方法和注意事项.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
有机物A的结构简式为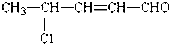 ,回答下列问题:
,回答下列问题:
(1)A中包含官能团的名称是 、 、 ;
(2)有机物A 不可能发生的化学反应是 (填写反应序号).①被酸性KMnO4氧化 ②聚合 ③加成④消去 ⑤还原⑥酯化⑦水解.
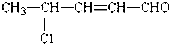 ,回答下列问题:
,回答下列问题:(1)A中包含官能团的名称是
(2)有机物A 不可能发生的化学反应是
下列有关反应热的说法中正确的是( )
A、己知C(s)+O2(g)=CO2(g);△H1C(s)+
| ||
| B、中和热△H=-57.3kJ?mol-1,所以1.00L 1.00mol?L-1H2SO4与稀的NaOH溶液恰好完全反应放出57.3kJ的热量 | ||
| C、用等体积的0.50mol?L-1盐酸、0.55mol?L-1NaOH溶液进行中和热测定的实验,会使测得的值偏大 | ||
| D、在101KPa时,1molCH4完全燃烧生成CO2和水蒸气放出的热量就是CH4的燃烧热 |
某温度下,反应H2(g)+I2(g)?2HI(g);(正反应为放热反应).在一带有活塞的密闭容器中达到平衡,下列说法中不正确的是( )
| A、恒容,充入H2,I2百分含量降低 |
| B、恒温,压缩体积,平衡不移动,颜色加深 |
| C、恒容,升温,正反应速率减小 |
| D、恒压,充入HI,开始时正反应速率减小 |
下列事实与胶体性质无关的是( )
| A、水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染 |
| B、一束平行光线射入氢氧化铁胶体里,从侧面可以看到一条光亮的通路 |
| C、将植物油倒入水中用力搅拌形成油水混合物 |
| D、氢氧化铁胶体中滴入稀硫酸,先看到红褐色沉淀生成而后沉淀溶解 |
 用Na2CO3固体配制1mol/L的Na2CO3溶液100mL.
用Na2CO3固体配制1mol/L的Na2CO3溶液100mL.