题目内容
有Na2SO4和Na2CO3混合溶液10.0mL,加入足量BaCl2溶液,充分反应后,经过滤、洗涤和烘干,得到白色沉淀1.451g,将沉淀与过量盐酸反应,得到112mL CO2气体(标准状况),求原混合溶液中Na2SO4和Na2CO3的物质的量浓度.
答案:
解析:
解析:
|
解:1.451g沉淀为BaSO4和BaCO3的混合物. 由Na2CO3~BaCO3~CO2 1mol 22.4L n(Na2CO3) 112×10-3L 知n(Na2CO3)=0.005mol m(BaCO3)=0.005×197=0.985g m(BaSO4)=1.451-0.985=0.466g 由Na2SO4~BaSO4 1mol 1mol n(Na2SO4) n(Na2SO4)=0.002mol 故c(Na2CO3)= c(Na2SO4)= 答:略. |

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
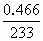 =0.002
=0.002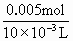 =0.500mol·L-1,
=0.500mol·L-1,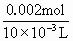 =0.200mol·L-1.
=0.200mol·L-1.