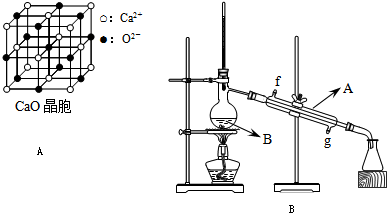
题目内容
有A、B、C三种一元碱,它们的相对分子质量之比为3∶5∶7,在它们的混合物中分子数之比为2∶1∶3,若将此混合物6.4g与44.5mL浓度为15%(ρ=1.102g/cm3)的硫酸溶液混合,恰好完全反应,求三种碱中金属的相对原子质量.
答案:
解析:
解析:
|
解:依题意,此三种碱中OH-的物质的量为硫酸中H+的物质的量 即: 混合物中分子数比=混合物中各物质的物质的量之比=2∶1∶3 则A、B、C三种碱物质的量之比=0.05∶0.025∶0.075 设A、B、C三种碱的摩尔质量分别为3x、5x、7x g/mol ∴0.05·3x+0.025·5x+0.075·7x=6.4 x=8 ∴3x=24g/mol 5x=40g/mol 7x=56g/mol A、B、C三种碱的相对分子质量分别为24、40、56 ∴金属的相对原子质量分别为24-17=7 40-17=23 56-17=39 答:(略) |

练习册系列答案
相关题目

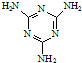
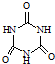
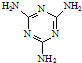 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸( 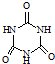 )后,三聚氰酸与三聚氰胺分子相互之间通过
)后,三聚氰酸与三聚氰胺分子相互之间通过