题目内容
用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A、常温常压下,18g2H2O含有的原子总数目为3NA |
| B、标准状况下,22.4L水含有的分子数目为NA |
| C、1 molNa在O2中完全燃烧转移的电子数目为NA |
| D、1mol?L-1KHSO4溶液中含有的钾离子数目为NA |
考点:阿伏加德罗常数
专题:
分析:A、2H2O的摩尔质量为20g/mol;
B、标况下,水为液态;
C、根据反应后钠元素的价态为+1价来分析;
D、溶液体积不明确.
B、标况下,水为液态;
C、根据反应后钠元素的价态为+1价来分析;
D、溶液体积不明确.
解答:
解:A、2H2O的摩尔质量为20g/mol,故18g2H2O的物质的量n=
=0.9mol,而1mol2H2O中含3mol原子,故0.9mol2H2O中含2.7mol原子,故A错误;
B、标况下,水为液态,故B错误;
C、反应后钠元素的价态为+1价,故1mol钠转移1mol电子,故C正确;
D、溶液体积不明确,溶液中钾离子的个数无法计算.
故选C.
| 18g |
| 20g/mol |
B、标况下,水为液态,故B错误;
C、反应后钠元素的价态为+1价,故1mol钠转移1mol电子,故C正确;
D、溶液体积不明确,溶液中钾离子的个数无法计算.
故选C.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各组离子在酸性溶液中可以大量共存的是( )
| A、Ba2+ NO3- NH4+ |
| B、Na+ K+ SO32- |
| C、Ca2+ CO32- Cl- |
| D、ClO- Na+ NH4+ |
下列化学用语或模型表达正确的是( )
A、8个中子的碳原子的核素符号:
| ||
B、H2O的电子式: | ||
C、Cl-的结构示意图: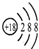 | ||
D、CH4分子的比例模型: |
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、标准状况下,22.4L CCl4含有C-Cl键的数目为4NA |
| B、取50mL 14.0mol/L浓硝酸与足量铜片反应,生成气体分子的数目为0.35NA |
| C、反应NH4N3?2N2↑+2H2↑,标准状况下每生成22.4L N2,转移电子的数目为2NA |
| D、电解精炼铜时,若转移的电子数为NA个,则阳极质量减少32g |
 以下表及图中分别表示物质间的从属关系,其中不正确的是( )
以下表及图中分别表示物质间的从属关系,其中不正确的是( )| X | Y | Z | H | |
| A | 分散系 | 胶体 | 溶液 | 烟 |
| B | 电解质 | 酸 | 碱 | 含氧酸 |
| C | 氧化物 | 酸性氧化物 | 碱性氧化物 | 非金属氧化物 |
| D | 元素周期表的纵列 | 主族 | 副族 | 卤族 |
| A、A | B、B | C、C | D、D |
下列各原子构成的单质,肯定能与稀硫酸反应产生H2的是( )
| A、原子核内没有中子 |
| B、M层有5个电子 |
| C、原子核外最外层电子数=电子层数 |
| D、N层上电子数与K层电子数相等,次外层有8个电子 |

 E.CH3CH2CH2CH3和
E.CH3CH2CH2CH3和


