题目内容
5.下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )| A. | 0.2 mol•L-1 NH3•H2O溶液与0.1 mol•L-1盐酸等体积混合:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| B. | 0.1 mol•L-1 NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | 向0.2 mol•L-1 NaHCO3溶液中加入等体积的 0.1 mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 0.1 mol•L-1 Na2CO3溶液:c(HCO3-)+c(H2CO3)=c(OH-)-c(H+) |
分析 A.反应后溶质为等浓度的一水合氨和氯化铵,一水合氨的电离程度大于铵根离子的水解程度,溶液呈碱性,则c(NH4+)>c(Cl-)、c(OH-)>c(H+);
B.碳酸氢钠溶液中,碳酸氢根离子的电离程度小于其水解程度,溶液呈碱性,则c(H2CO3)>c(CO32-);
C.反应后溶质为等浓度的碳酸氢钠和碳酸钠,碳酸根离子的水解程度大于碳酸氢根离子,则c(HCO3-)>c(CO32-);
D.根据碳酸钠溶液中的质子守恒判断.
解答 解:A.0.2 mol•L-1 NH3•H2O溶液与0.1 mol•L-1盐酸等体积混合,反应后溶质为等浓度的氯化铵和一水合氨,铵根离子的水解程度小于一水合氨的电离程度,溶液呈碱性,则c(OH-)>c(H+)、c(NH4+)>c(NH3•H2O),结合物料守恒可知:c(NH4+)>c(Cl-),溶液中离子浓度大小为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),故A正确;
B.0.1 mol•L-1 NaHCO3溶液中,HCO3-的电离程度小于其水解程度,则c(H2CO3)>c(CO32-),正确的离子浓度大小为:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故B错误;
C.向0.2 mol•L-1 NaHCO3溶液中加入等体积的 0.1 mol•L-1NaOH溶液,反应后溶质为等浓度的碳酸钠和碳酸氢钠,由于碳酸根离子的水解程度大于碳酸氢根离子的水解程度,则:c(HCO3-)>c(CO32-),正确的离子浓度大小为:c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故C错误;
D.Na2CO3本身不含氢离子和氢氧根,故溶液中所有的氢原子和氢氧根均来自于水且相等,即满足质子守恒:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-),整理可得:c(HCO3-)+2c(H2CO3)=c(OH-)-c(H+),故D错误;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒及质子守恒的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.

| A. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag | |
| B. | 铁溶于盐酸中:Fe+6H+═Fe3++3H2↑ | |
| C. | 氯化铝溶液和氨水反应 Al3++NH3•H2O═Al(OH)3↓+NH4+ | |
| D. | NaHCO3溶液与HCl溶液反应:H++HCO3-═CO2↑+H2O |
| A. | 氯酸钾和二氧化锰 | B. | 氯化铵和碘 | ||
| C. | 氯化铵和硫酸钠 | D. | 氯化钠和溴化钾 |
| A. | X为0.2 mol•L-1 | |
| B. | Y为0.1 mol•L-1 | |
| C. | Z为0.4 mol•L-1 | |
| D. | Z为0.1 mol•L-1时,Y为0.15 mol•L-1 |
| A. | 24克/摩 | B. | $\frac{1}{24}$ 克 | C. | $\frac{{N}_{A}}{24}$克 | D. | $\frac{24}{{N}_{A}}$克 |
 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为CH3COOH>H2CO3>HClO.
(2)同浓度CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为CO32->ClO->HCO3->CH3COO-.
(3)将少量CO2气体通入NaClO溶液中,写出反应的离子方程式:ClO-+CO2+H2O=HCO3-+HClO.
(4)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,填写下列表达式中的数据变化情况(填“变大”、“变小”或“不变”)
①$\frac{{c(C{H_3}COOH)}}{{c({H^+})}}$变小;②$\frac{{c(C{H_3}CO{O^-})•c({H^+})}}{{c(C{H_3}COOH)}}$不变;
③$\frac{{c(C{H_3}CO{O^-})}}{{c(C{H_3}COOH)}}$变大;④$\frac{{c(C{H_3}CO{O^-})}}{{c(C{H_3}COOH)•c(O{H^-})}}$不变.
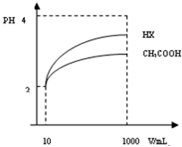
(5)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数:理由是当完全电离时应该是PH=4,现在PH值HX>CH3COOH,说明原来HX电离更多,故HX的电离平衡常数>醋酸的电离平衡常数.
| A. | CuS | B. | FeS2 | C. | Cu2S | D. | SO3 |
| A. | Fe2+、Cl-、NO3-、K+ | B. | K+、Mg2+、Cl-、SO42- | ||
| C. | Na+、Br-、NO3-、S2- | D. | K+、CO32-、Na+、AlO2- |