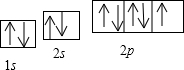
题目内容
经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.下列判断正确的是( )
| A.AlCl3为离子化合物 | B.SiCl4为共价化合物 |
| C.P 与Cl可形成离子键 | D.K与Mg 形成共价键 |
A.Al的电负性为1.5,Cl的电负性为3.0,电负性差值为1.5,小于1.7,为共价键,则AlCl3为共价化合物,故A错误;
B.Si的电负性为1.8,Cl的电负性为3.0,电负性差值为1.2,小于1.7,为共价键,SiCl4为共价化合物,故B正确;
C.P的电负性为2.1,Cl的电负性为3.0,电负性差值为0.9,小于1.7,为共价键,故C错误;
D.K与Mg都是金属,二者之间不能形成共价键,况且电负性差值为0.4,故D错误.
故选B.
B.Si的电负性为1.8,Cl的电负性为3.0,电负性差值为1.2,小于1.7,为共价键,SiCl4为共价化合物,故B正确;
C.P的电负性为2.1,Cl的电负性为3.0,电负性差值为0.9,小于1.7,为共价键,故C错误;
D.K与Mg都是金属,二者之间不能形成共价键,况且电负性差值为0.4,故D错误.
故选B.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2011?咸阳模拟)[化学-选修物质结构与性质]
(2011?咸阳模拟)[化学-选修物质结构与性质]