题目内容
12.100mL0.6mol•L-1盐酸加到等体积0.4mol•L-1NaOH溶液中,所得溶液中的 pH值是( )| A. | 0.2 | B. | 0.7 | C. | 1.0 | D. | 2.0 |
分析 100mL0.6mol•L-1盐酸加到等体积0.4mol•L-1NaOH溶液中,盐酸过量,混合后溶液显酸性,故应根据氢离子浓度c(H+)=$\frac{n({H}^{+})-n(O{H}^{-})}{{V}_{混}}$计算出溶液的pH,据此分析.
解答 解:100mL0.6mol•L-1盐酸加到等体积0.4mol•L-1NaOH溶液中,盐酸过量,混合后溶液显酸性,故混合后溶液中的氢离子浓度c(H+)=$\frac{n({H}^{+})-n(O{H}^{-})}{{V}_{混}}$=$\frac{0.6mol/L×0.1L-0.4mol/L×0.1L}{0.2L}$=0.1mol/L,故pH=1,故选C.
点评 本题考查酸酸混合pH的计算,明确浓度与pH的换算是解答本题的关键,题目难度中等.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
3.实验室中用苯甲醛制备苯甲醇和苯甲酸,已知反应原理为

部分试剂的物理常数如下表所示:
制备苯甲醇和苯甲酸的主要过程如下:
在锥形瓶中,加13.5g KOH、13.5mL H2O,在不断振荡下分批加入新制的苯甲醛,共加入15mL新制的苯甲醛,塞紧瓶口,用力振摇得到白色糊状物,放置24h以上.
向锥形瓶中加入大约45mL水,使反应混合物中的苯甲酸盐溶解,转移至分液漏斗中,用45mL乙醚分三次萃取苯甲醇,合并乙醚萃取液.保存水溶液留用.
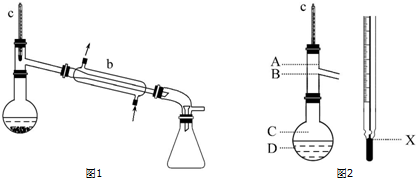
依次用15mL 25%的亚硫酸氢钠溶液及8mL水洗涤乙醚萃取液,再加入少量无水硫酸镁静置片刻,过滤除去MgSO4固体.把乙醚萃取液倒入圆底烧瓶,加入2小片碎瓷片,先水浴蒸馏,再用酒精灯加热蒸馏,收集产品可得苯甲醇(装置如图1所示).
制取纯净苯甲酸的过程略.
试完成下列问题:
(1)仪器b的名称为冷凝管.
(2)混合苯甲醛、氢氧化钾和水应选用的锥形瓶要用胶塞塞住,其原因是防止苯甲醛被空气中的氧气氧化.
(3)若将苯甲醛一次性倒入锥形瓶,可能导致A、D.
A.反应太剧烈B.液体太多无法振荡C.反应变缓慢D.产率降低
(4)分液漏斗使用前须检查是否漏水(或检漏)并洗净备用.
(5)制取苯甲醇时,用25%亚硫酸氢钠溶液洗涤是为了除去未反应的苯甲醛.实验中加入少量无水MgSO4的目的是干燥乙醚萃取液.
(6)在使用图2所示仪器的操作中,温度计水银球的上沿X的放置位置为B(填图示“A”“B”“C”或“D”).
(7)蒸馏过程中水浴加热蒸出的主要为乙醚,然后加热收集沸点204~206℃的馏分得到苯甲醇.某同学一次实验中发现温度在178~180℃时有少量液体蒸出,则该馏分可能为苯甲醛.

部分试剂的物理常数如下表所示:
| 名称 | 性状 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 水溶性 |
| 苯甲醛 | 无色液体,苦杏仁味 | -26 | 178.1 | 1.041 5 | 微溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.4 | 248 | 1.265 9 | 微溶 |
| 苯甲醇 | 无色液体,有芳香味 | -15.3 | 205.35 | 1.041 9 | 微溶 |
| 乙醚 | 无色透明液体, 有特殊刺激性气味 | -116.3 | 34.6 | 0.71 | 不溶 |
在锥形瓶中,加13.5g KOH、13.5mL H2O,在不断振荡下分批加入新制的苯甲醛,共加入15mL新制的苯甲醛,塞紧瓶口,用力振摇得到白色糊状物,放置24h以上.
向锥形瓶中加入大约45mL水,使反应混合物中的苯甲酸盐溶解,转移至分液漏斗中,用45mL乙醚分三次萃取苯甲醇,合并乙醚萃取液.保存水溶液留用.
依次用15mL 25%的亚硫酸氢钠溶液及8mL水洗涤乙醚萃取液,再加入少量无水硫酸镁静置片刻,过滤除去MgSO4固体.把乙醚萃取液倒入圆底烧瓶,加入2小片碎瓷片,先水浴蒸馏,再用酒精灯加热蒸馏,收集产品可得苯甲醇(装置如图1所示).
制取纯净苯甲酸的过程略.

试完成下列问题:
(1)仪器b的名称为冷凝管.
(2)混合苯甲醛、氢氧化钾和水应选用的锥形瓶要用胶塞塞住,其原因是防止苯甲醛被空气中的氧气氧化.
(3)若将苯甲醛一次性倒入锥形瓶,可能导致A、D.
A.反应太剧烈B.液体太多无法振荡C.反应变缓慢D.产率降低
(4)分液漏斗使用前须检查是否漏水(或检漏)并洗净备用.
(5)制取苯甲醇时,用25%亚硫酸氢钠溶液洗涤是为了除去未反应的苯甲醛.实验中加入少量无水MgSO4的目的是干燥乙醚萃取液.
(6)在使用图2所示仪器的操作中,温度计水银球的上沿X的放置位置为B(填图示“A”“B”“C”或“D”).
(7)蒸馏过程中水浴加热蒸出的主要为乙醚,然后加热收集沸点204~206℃的馏分得到苯甲醇.某同学一次实验中发现温度在178~180℃时有少量液体蒸出,则该馏分可能为苯甲醛.
20.已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高.则下列溶液沸点最高的是( )
| A. | 0.01 mol•L-1的蔗糖溶液 | B. | 0.01 mol•L-1的CaCl2溶液 | ||
| C. | 0.02 mol•L-1的NaCl溶液 | D. | 0.02 mol•L-1的CH3COOH溶液 |
17.下列物质中,属于强电解质的是( )
| A. | NH3•H2O | B. | H2O | C. | KOH | D. | CH3COOH |
1.化学反应常伴随着颜色变化,下列现象描述不正确的是( )
| A. | 无色一氧化氮气体与空气接触变为红棕色 | |
| B. | 往盐酸中滴加紫色石蕊试液,溶液变红色 | |
| C. | 向硫酸铜溶液中滴加氢氧化钠溶液,出现白色沉淀 | |
| D. | 将足量二氧化硫气体通入品红溶液,红色逐渐褪去 |