题目内容
【题目】以粉煤灰(主要成分为Al2O3、SiO2,还含少量Fe2O3等)为原料制取氧化铝的部分工艺流程如下:
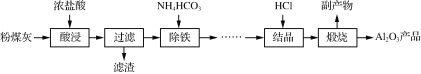
(1)“酸浸”过程发生的主要反应的离子方程式是_______________________________________________。
“酸浸”在恒容密闭反应釜中进行,温度不宜过高的原因是________________________________________________________________________。
(2)“除铁”生成Fe(OH)3的离子方程式为_________________,检验溶液中铁元素已经除尽的方法是________________________________________________________________________。
(3)“结晶”是向浓溶液中通入HCl气体,从而获得AlCl3·6H2O晶体的过程,溶液中Al3+和盐酸的浓度随通气时间的变化如下图所示。Al3+浓度减小的原因是_________________________。

(4)上述流程中,可以循环利用的物质是____。
【答案】Al2O3+6H+===2Al3++3H2O 温度太高,盐酸大量挥发会引起容器内压强过大,导致反应釜损坏 Fe3++3![]() ===Fe(OH)3↓+3CO2↑ 静置,取少量上层清液于试管中,滴入KSCN溶液,溶液不变红色 盐酸浓度增大,溶液中Cl-浓度增大,促进Al3+形成AlCl3·6H2O晶体析出 HCl(或盐酸)
===Fe(OH)3↓+3CO2↑ 静置,取少量上层清液于试管中,滴入KSCN溶液,溶液不变红色 盐酸浓度增大,溶液中Cl-浓度增大,促进Al3+形成AlCl3·6H2O晶体析出 HCl(或盐酸)
【解析】
制备Al2O3的流程:粉煤灰的主要成分为Al2O3和SiO2(含少量杂质Fe2O3),加浓盐酸,Al2O3、Fe2O3转化为离子,SiO2不溶于盐酸,过滤,滤渣为SiO2,滤液中含有Al3+、Fe3+,加入适量碳酸氢铵,Fe3+转化为沉淀从而达到除铁的目的,滤液中氯化铝在氯化氢的氛围中加热结晶得AlCl3·6H2O晶体,AlCl3·6H2O晶体煅烧得到Al2O3以及副产品氯化氢,据此分析解答。
制备Al2O3的流程:粉煤灰的主要成分为Al2O3和SiO2(含少量杂质Fe2O3),加浓盐酸,Al2O3、Fe2O3转化为离子,SiO2不溶于盐酸,过滤,滤渣为SiO2,滤液中含有Al3+、Fe3+,加入适量碳酸氢铵,Fe3+转化为沉淀从而达到除铁的目的,滤液中氯化铝在氯化氢的氛围中加热结晶得AlCl3·6H2O晶体,AlCl3·6H2O晶体煅烧得到Al2O3以及副产品氯化氢。
(1)“酸浸”过程发生的主要反应为氧化铝与盐酸反应生成氯化铝和水,反应的离子方程式是Al2O3+6H+=2Al3++3H2O;
“酸浸”在恒容密闭反应釜中进行,温度太高,盐酸大量挥发会引起容器内压强过大,导致反应釜损坏,故温度不宜过高;
(2)“除铁”生成Fe(OH)3是氯化铁与碳酸氢铵发生双水解反应生成氢氧化铁、氯化铵和二氧化碳,反应的离子方程式为Fe3++3HCO![]() =Fe(OH)3↓+3CO2↑,检验溶液中铁元素已经除尽的方法是静置,取少量上层清液于试管中,滴入KSCN溶液,溶液不变红色;
=Fe(OH)3↓+3CO2↑,检验溶液中铁元素已经除尽的方法是静置,取少量上层清液于试管中,滴入KSCN溶液,溶液不变红色;
(3) 盐酸浓度增大,溶液中Cl-浓度增大,促进Al3+形成AlCl3·6H2O晶体析出,Al3+浓度减小;
(4)上述流程中,结晶时必须用到氯化氢,而副产品为氯化氢,故可以循环利用的物质是HCl(或盐酸)。

 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案【题目】钴的化合物用途广泛。一种利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等)制取CoCl2·6H2O粗品的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式完全沉淀时的pH如下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔点为86℃,加热至110℃~120℃时,失去结晶水生成无水氯化钴。
请回答下列问题:
(1)写出“浸出”时Co2O3发生反应的离子方程式:_____________________________。
(2)加入NaClO3的作用是______________________________。
(3)萃取剂对金属离子的萃取率与pH的关系如下图所示。向“滤液II”中加入萃取剂的主要目的是___________________,使用萃取剂时最适宜的pH是_____(填字母序号)。
A.2.0~2.5 B.3.0~3.5 C5.0~5.5 D.9.5~9.8

(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知某温度下,Ksp(MgF2)=7.35×10-11 , Ksp(CaF2)=1.05×10-10 。 当加入过量NaF后,所得滤液c (Mg2+)/c (Ca2+)=________。
(5)制得的CoCl2·6H2O粗品经进一步提纯得到CoCl2·6H2O晶体,在烘干晶体时需采用减压烘干,其原因是___________________________________________。


