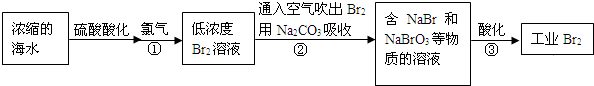
题目内容
含有下列各组离子的溶液中,通入过量SO2气体后仍能大量共存的是( )
| A、H+、Ca2+、Fe3+、NO3- |
| B、Ba2+、ClO-、Na+、OH- |
| C、Na+、NH4+、I-、HS- |
| D、Na+、Ca2+、K+、Cl- |
考点:离子共存问题,二氧化硫的化学性质
专题:离子反应专题,氧族元素
分析:A.硝酸根离子在酸性条件下具有强氧化性,能够将二氧化硫氧化成氧化成硫酸根离子,钙离子与硫酸根离子反应生成硫酸钙沉淀;
B.次氯酸根离子能够将二氧化硫氧化成硫酸根离子,硫酸根离子与钡离子反应生成硫酸钡沉淀,氢氧根离子能够与二氧化硫反应;
C.HS-能够与二氧化硫发生反应生成硫单质;
D.Na+、Ca2+、K+、Cl-之间不发生反应,通入二氧化硫后也不发生反应.
B.次氯酸根离子能够将二氧化硫氧化成硫酸根离子,硫酸根离子与钡离子反应生成硫酸钡沉淀,氢氧根离子能够与二氧化硫反应;
C.HS-能够与二氧化硫发生反应生成硫单质;
D.Na+、Ca2+、K+、Cl-之间不发生反应,通入二氧化硫后也不发生反应.
解答:
解:A.NO3-在酸性条件下能够将SO2氧化成硫酸根离子,硫酸根离子与Ca2+反应生成硫酸钙,在溶液中不能大量共存,故A错误;
B.ClO-、OH-能够与SO2发生反应硫酸根离子,硫酸根离子能够与钡离子反应生成沉淀,在溶液中不能大量共存,故B错误;
C.HS-与SO2发生氧化还原反应生成S单质,在溶液中不能大量共存,故C错误;
D.Na+、Ca2+、K+、Cl-之间不反应,也不与SO2发生反应,在溶液中能够大量共存,故D正确;
故选D.
B.ClO-、OH-能够与SO2发生反应硫酸根离子,硫酸根离子能够与钡离子反应生成沉淀,在溶液中不能大量共存,故B错误;
C.HS-与SO2发生氧化还原反应生成S单质,在溶液中不能大量共存,故C错误;
D.Na+、Ca2+、K+、Cl-之间不反应,也不与SO2发生反应,在溶液中能够大量共存,故D正确;
故选D.
点评:本题考查离子共存的正误判断,难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能生成难溶物的离子之间;能发生氧化还原反应的离子之间等;解决离子共存问题时还应该注意题目所隐含的条件,本题中“通入过量SO2气体后仍能大量共存”.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
氨甲环酸和氨甲苯酸是临床上常用的止血药,其结构如图所示:
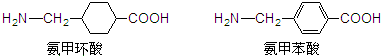
下列说法错误的是( )
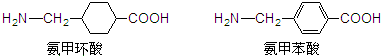
下列说法错误的是( )
| A、氨甲环酸、氨甲苯酸都既能溶于盐酸,又能溶于NaOH溶液 |
| B、氨甲苯酸属于芳香族α-氨基酸的同分异构体和苯丙氨酸互为同系物 |
| C、氨甲环酸、氨甲苯酸都能发生取代、氧化、缩聚、加成等反应 |
| D、氨甲环酸、氨甲苯酸中各有5种不同的氢原子 |
下列表示对应化学反应的离子方程式正确的是( )
| A、明矾溶液中滴加过量氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+ |
| B、醋酸溶液与Mg(OH)2反应:Mg(OH)2+2H+═Mg2++2H2O |
| C、小苏打溶液中加足量澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- |
| D、SO2通入FeCl3溶液中:SO2+Fe3++2H2O═SO42-+Fe2++4H+ |
结合如图装置判断,下列叙述正确的是( )
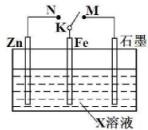

| A、若X为NaCl,K与M相连时,石墨电极反应为2Cl--2e-═Cl2↑ |
| B、若X为硫酸,K与M相连时,Fe作负极受到保护 |
| C、若X为硫酸,K与N相连时,溶液中H+向Fe电极移动 |
| D、若X为NaCl,K与N相连时,溶液中加入少量K3[Fe(CN)6],有蓝色沉淀生成 |
某小分子抗癌药物的分子结构如图所示,下列说法正确的是( )
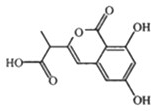

| A、1mol该有机物最多可以和5mol NaOH反应 |
| B、1mol该有机物与浓溴水反应,最多消耗3mol Br2 |
| C、该有机物遇FeCl3溶液不变色,但可使酸性KMnO4溶液褪色 |
| D、该有机物容易发生加成、取代、中和、消去等反应 |
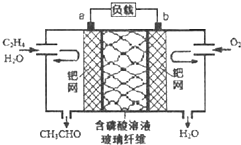 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )| A、该电池为可充电电池 |
| B、每有0.1mol O2反应,则迁移H+0.4mol |
| C、正极反应式为:CH2=CH2-2e-+2OH-═CH3CHO+H2O |
| D、电子移动方向:电极a→磷酸溶液→电极b |