题目内容
15.取一定量碳酸钠和碳酸氢钠的固体混合物样品,分成两等份,对其中一份样品进行加热完全分解产生CO2 112mL,另一份样品溶于水,向所得溶液中逐滴加入150mL稀盐酸时产生CO2 112mL,过量时产生CO2 448L(气体体积均为标准状况)(1)碳酸氢钠与碳酸钠的物质的量之比1:1.
(2)盐酸物质的量浓度为0.1mol/L.(保留2位有效数字)
分析 (1)根据反应2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O 可计算出混合物中碳酸氢钠的物质的量;另一份中加入过量盐酸生成标准状况下448mL的二氧化碳,根据碳原子守恒可计算出混合物的总物质的量,然后根据碳酸氢钠的物质的量可知碳酸钠的物质的量,从而可计算出碳酸氢钠和碳酸钠的物质的量之比;
(2)向碳酸钠、碳酸氢钠的混合物中加入少量盐酸,碳酸钠优先反应生成碳酸氢钠,然后碳酸氢钠与盐酸反应生成二氧化碳,结合反应方程式计算出150mL稀盐酸中含有氯化氢的物质的量,最高价c=$\frac{n}{V}$计算出该盐酸的浓度.
解答 解:(1)对其中一份样品进行加热完全分解产生CO2 112mL,则
2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O
2mol 22.4L
n(NaHCO3) 0.112L
n(NaHCO3)=$\frac{2mol×0.112L}{22.4L}$=0.01mol,
另一份样品溶于水,向所得溶液中逐滴加入过量盐酸时产生标准状况下448mLCO2 ,该二氧化碳的物质的量为:$\frac{0.448L}{22.4L/mol}$=0.02mol,根据C原子守恒可知混合物中碳酸钠、碳酸氢钠的物质的量为0.2mol,则混合物中碳酸钠的物质的量为:0.02mol-0.01mol=0.01mol,
所以混合物中碳酸氢钠与碳酸钠的物质的量之比=0.01mol:0.01mol=1:1,
故答案为:1:1;
(2)先碳酸钠、碳酸氢钠的混合物中加入稀盐酸时,碳酸钠优先反应,根据反应Na2CO3+HCl═NaHCO3+NaCl可知,0.01mol碳酸钠完全反应化学HCl的物质的量为0.1mol,然后发生反应:NaHCO3+HCl═NaCl+CO2↑+H2O,生成标准状况下112mL二氧化碳时消耗HCl的物质的量为:n(HCl)=n(CO2)=$\frac{0.112L}{22.4L/mol}$=0.005mol,则150mL该稀盐酸中含有HCl的物质的量为:0.01mol+0.005mol=0.015mol,
所以该稀盐酸的物质的量浓度为:$\frac{0.015mol}{0.15L}$=0.1mol/L,
故答案为:0.1mol/L.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的先后顺序为解答关键,注意掌握物质的量与摩尔质量、物质的量浓度之间的关系,试题培养了学生的化学计算能力.

 将CO2气体缓缓通入到含有等物质的量的KOH、Ba(OH)2和KAlO2的混合溶液中,直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示(假设每步反应均完全).下列关于整个反应进程中的各种描述不正确的是( )
将CO2气体缓缓通入到含有等物质的量的KOH、Ba(OH)2和KAlO2的混合溶液中,直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示(假设每步反应均完全).下列关于整个反应进程中的各种描述不正确的是( )| A. | d~e段沉淀的减少是由碳酸钡固体的消失所致 | |
| B. | b~c段反应的离子方程式是:2A1O2-+3H2O+CO2=2A1(OH)3↓+CO32- | |
| C. | 0~a段反应的化学方程式是:Ba(OH)2+CO2=BaCO3↓+H2O | |
| D. | a~b段与c~d段所发生的反应相同 |
| A. | 3px<3py | B. | 2s<2p | C. | 3s<3d | D. | 4s>3p |
| A. | 摩尔是物质的量的单位,每摩尔物质含有6.02×1023个分子 | |
| B. | 2H既可表示2个氢原子,又可表示2mol氢原子 | |
| C. | 1mol氯含有6.02×1023个电子 | |
| D. | 阿伏伽德罗常数数值近似值为6.02×1023 |

| 甲 | 乙 | 丙 | |
| A | Na2CO3 | NaHCO3 | CO2 |
| B | Mg(OH)2 | MgCO3 | CO2 |
| C | NaAlO2 | Al(OH)3 | AlCl3 |
| D | Al(OH)3 | Al | AlCl3 |
| A. | 生成由易到难:HF>HCl>HBr>HI | B. | 稳定性:HF<HCl<HBr<HI | ||
| C. | 酸性:HF>HCl>HBr>HI | D. | 酸性:HClO4<HBrO4<HIO4 |
| A. | ②④⑤ | B. | ①⑥⑦ | C. | ⑦④⑥ | D. | ①③⑥ |
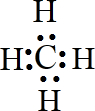 ,食醋中的有机物结构式
,食醋中的有机物结构式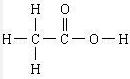 ,乙烯水化法所得产物的结构简式CH3CH2OH.
,乙烯水化法所得产物的结构简式CH3CH2OH. 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.