题目内容
【题目】A~H为中学化学中几种常见物质,它们之间的转化关系如下图所示。常温下,A和G均为单质气体,同体C常用作干燥剂,E为无色、无味的液体,F为淡黄色粉末。

回答下列问题:
(1)F的化学式为________,反应Ⅱ中每生成1molG,转移电子数目为________。
(2)反应工的化学方程式为________。
【答案】Na2O21.204×10242Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
【解析】E为无色、无味的液体,应为水,F为淡黄色粉末且能与水反应生成气体单质,则F为Na2O2;C为常用干燥剂,可能为CaCl2;则A为Cl2,B为Ca(OH)2;
(1)F的化学式为Na2O2;反应Ⅱ是2Na2O2+2H2O=4NaOH+O2,此反应中每生成1molO2,转移电子的物质的量为2mol,电子数目为2NA或1.204×1024;
(2)反应I为工业制漂白粉,此反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。

 灵星计算小达人系列答案
灵星计算小达人系列答案【题目】1L某混合溶液中可能含有的离子如下表:
可能大量含有的阳离子 | H+、NH4+ 、Al3+、K+ |
可能大量含有的阴离子 | Cl﹣、Br﹣、I﹣、ClO﹣、AlO2﹣ |
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(v)的关系如图所示.
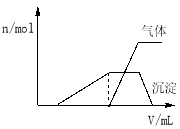
①则该溶液中确定含有的离子有 ;
②不能确定是否含有的阳离子有 ;
③要确定其存在可补充做的实验是 ;
④肯定不存在的阴离子有 .
(2)经检测,该溶液中含有大量的Cl﹣、Br﹣、I﹣,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl﹣、Br﹣、I﹣的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
n(Cl﹣) | 1.25mol | 1.5mol | 2mol |
n(Br﹣) | 1.5mol | 1.4mol | 0.9mol |
n(I﹣) | a mol | 0 | 0 |
①当通入Cl2的体积为2.8L时,溶液中发生反应的离子方程式为 .
②原溶液中Cl﹣、Br﹣、I﹣的物质的量浓度之比为 .
