题目内容
11.糖类、油脂、蛋白质都是人体必需的营养物质.请回答:(1)下列物质中①葡萄糖②麦芽糖③蔗糖④纤维素⑤淀粉,互为同分异构体的是②③;具有还原性,能发生银镜反应的是①②.(填序号)
(2)油脂在酸性环境下的水解产物为高级脂肪酸、甘油(写名称)
(3)向蛋白质溶液中加入饱和(NH4)2SO4溶液可使蛋白质盐析(填“盐析”或“变性”).
分析 (1)分子式相同,结构不同的化合物互为同分异构体;葡萄糖和麦芽糖属于还原性糖;
(2)油脂是高级脂肪酸甘油酯;
(3)当向蛋白质溶液中加入的非重金属盐溶液达到一定浓度时,反而使蛋白质的溶解度降低而从溶液中析出,这种作用叫盐析,盐析是可逆的;
解答 解:(1)蔗糖和麦芽糖的分子式均为C12H22O11,且结构不相同,属于同分异构体;淀粉与纤维素都的分子式都为(C6H10O5)n,但聚合度n值不同,不是同分异构体;
葡萄糖和麦芽糖属于还原性糖,能发生银镜反应的是①②;
故答案为:②③;①②;
(2)油脂是高级脂肪酸甘油酯,在酸性条件下水解生成高级脂肪酸、甘油;
故答案为:高级脂肪酸、甘油;
(3)蛋白质溶液中加入饱和(NH4)2SO4溶液,(NH4)2SO4属于非重金属盐,蛋白质析出,再加水会溶解,属于蛋白质盐析,
故答案为:盐析.
点评 本题考查了糖类、油脂、蛋白质的组成和性质,题目难度不大,试题注重了基础知识的考查,注意明确油脂的组成、结构与性质,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
1.将等物质的量的氧化钠和过氧化钠分别放入等质量的过量的水中,得到溶液的质量分别为a g和b g,(设反应中水分不损失)则a和b的关系为( )
| A. | a<b | B. | a>b | C. | a=b | D. | 无法确定 |
2.下列各图所示的实验原理、方法、装置或操作,其中正确的是( )
| A. | 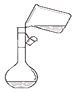 向容量瓶中转移溶液 | B. |  中和热的测定 | ||
| C. | 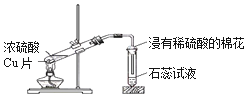 浓硫酸与铜的反应 | D. | 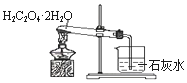 乙二酸晶体受热分解 |
19.粗盐提纯的实验中,不需要进行的操作是( )
| A. |  | B. |  | C. |  | D. |  |
6.某元素的一个原子的质量为a克,一个C-12原子的质量为b克,阿伏加德罗常数NA,则该原子的相对原子质量为( )
| A. | aNAg/mol | B. | $\frac{12a}{b}$ | C. | $\frac{a}{{N}_{A}}$ | D. | $\frac{12b}{a}$ |
3.下列说法正确的是( )
| A. | 天然气、石油都是可再生能源 | |
| B. | 在燃煤中添加生石灰可以减少SO2的排放 | |
| C. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| D. | 地沟油和矿物油都属于酯类物质 |
20.铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁.“速力菲”是市场上一种常见的补铁药品,其说明书部分内容摘录如下:
【规格】每片含琥珀酸亚铁0.1g
【适应症】用于缺铁性贫血症,预防及治疗用.
【贮藏】避光、密封、在干燥处保存.
【药物相互作用】与维生素C同服,可增加本品吸收;该药片在水和乙醇中溶解度不大
该药品中Fe2+会缓慢氧化.国家规定该药物中Fe2+的氧化率(已经被氧化Fe2+的质量与Fe2+总质量的比值)超过10.00% 即不能再服用.
(1)实验室可采用H2SO4酸化的KMnO4溶液,对“速力菲”中的Fe2+进行滴定(假设药品中其他成份不与KMnO4反应).滴定过程发生如下反应,请补充完整:
5Fe2++1MnO4-+=1Mn2++5Fe3++4H2O.
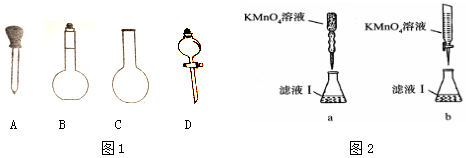
(2)实验前,称量含铁元素质量分数为20.00%的“速力菲”20.0g,将其全部溶于稀H2SO4中,配制成250ml溶液,配制时图1下列仪器肯定不需要的是烧瓶(园底烧瓶)分液漏斗.(填名称)
(3)取配制好的溶液20.00ml于锥形瓶中,用0.1000mol/L-1的KMnO4溶液滴定,某同学设计了图2滴定方式(夹持部分略去),最合理的是b(填字母序号);若滴定过程中,锥形瓶中待测液飞溅出来,则测出的Fe2+的氧化率偏高(填偏高、偏低或不变).
(4)三次操作读数如下:
计算该“速力菲”补铁药品Fe2+的氧化率为16%.
【规格】每片含琥珀酸亚铁0.1g
【适应症】用于缺铁性贫血症,预防及治疗用.
【贮藏】避光、密封、在干燥处保存.
【药物相互作用】与维生素C同服,可增加本品吸收;该药片在水和乙醇中溶解度不大

该药品中Fe2+会缓慢氧化.国家规定该药物中Fe2+的氧化率(已经被氧化Fe2+的质量与Fe2+总质量的比值)超过10.00% 即不能再服用.
(1)实验室可采用H2SO4酸化的KMnO4溶液,对“速力菲”中的Fe2+进行滴定(假设药品中其他成份不与KMnO4反应).滴定过程发生如下反应,请补充完整:
5Fe2++1MnO4-+=1Mn2++5Fe3++4H2O.
(2)实验前,称量含铁元素质量分数为20.00%的“速力菲”20.0g,将其全部溶于稀H2SO4中,配制成250ml溶液,配制时图1下列仪器肯定不需要的是烧瓶(园底烧瓶)分液漏斗.(填名称)
(3)取配制好的溶液20.00ml于锥形瓶中,用0.1000mol/L-1的KMnO4溶液滴定,某同学设计了图2滴定方式(夹持部分略去),最合理的是b(填字母序号);若滴定过程中,锥形瓶中待测液飞溅出来,则测出的Fe2+的氧化率偏高(填偏高、偏低或不变).
(4)三次操作读数如下:
| 序号 | V初 | V末 | V标 |
| 1 | 0.10mL | 9.71mL | 9.61mL |
| 2 | 1.50mL | 11.09mL | 9.59mL |
| 3 | 0.50mL | 11.10mL | 11.60mL |
1.配制一定体积、一定物质的量浓度的溶液,实验结果产生偏高影响的是( )
| A. | 容量瓶中原有少量蒸馏水 | B. | 溶解所用的烧杯未洗涤 | ||
| C. | 定容时仰视观察液面 | D. | 定容时俯视观察液面 |