题目内容
9.计算题.(1)已知在酸性条件下溴酸盐可发生如下离子反应:
Ⅰ.2BrO3-+10Cl-+12H+═5Cl2↑+Br2+6H2O
Ⅱ.6BrO3-+5Cl-+6H+═5ClO3-+3Br2+3H2O
Ⅲ.BrO3-+5Br-+6H+═3Br2+3H2O
现将120mL0.4mol•L-1KBrO3溶液和100mL 0.6mol•L-1KCl溶液在稀H2SO4中混合,充分反应后,产物KClO3和Cl2的物质的量之比为3:1.
(2)黑火药(硫黄、木炭和硝酸钾的混合物,杂质忽略不计)是我国的四大发明之一.现有黑火药样品124g,燃烧后生成33.6L(标准状况下)气体和由K2CO3、K2SO4组成的固体混合物.33.6L气体中CO和CO2占$\frac{2}{3}$,其余气体为N2.则该黑火药中硫黄的质量为8g.
分析 (1)KClO3和Cl2的物质的量物质的量分别为xmol、ymol,根据电子转移守恒及氯元素守恒列方程计算解答;
(2)根据气体的总体积计算出及二氧化碳、CO的体积得出大气体积,根据N元素守恒得出硝酸钾的物质的量;设出硫磺的物质的量为x,然后利用C元素、K元素守恒列式计算出硫磺的物质的量及质量.
解答 解:(1)设KClO3和Cl2的物质的量物质的量分别为xmol、ymol,
根据电子转移守恒及氯元素守恒列方程,则:$\left\{\begin{array}{l}{6x+2y=0.12×0.4×5}\\{x+2y=0.1×0.6}\end{array}\right.$,
解得x=0.036、y=0.012,
所以产物KClO3和Cl2的物质的量之比为0.036:0.012=3:1,
故答案为:3:1;
(2)反应的化学方程式为3C+S+2KNO3═K2S+3CO2+N2(民间常说的一硫二硝三木炭),由题意知燃烧后生成33.6L(标准状况下)气体,剩余N2为11.2L,即为0.5mol,根据氮元素守恒可知反应的KNO3的物质的量为1mol,质量为101g;根据钾离子守恒可知硫酸钾和碳酸钾的总物质的量为0.5mol,
设该黑火药中硫黄的物质的量为x,则硫酸钾的物质的量为x,碳酸钾的物质的量为0.5-x,
又知气体中含碳元素为1mol,质量为12g,
则:101g+12g+32x+12(0.5-x)g=124g,解得x=0.5mol,
所以硫磺的质量为:32g/mol×0.5mol=8g,
故答案为:8.
点评 本题考查了混合物反应的计算、氧化还原反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用方法.

练习册系列答案
相关题目
19.已知某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法中正确的是( )


| A. | 由红外光谱可知,该有机物的结构简式为CH3OH | |
| B. | 由核磁共振氢谱可知,该有机物分子中有3个氢原子 | |
| C. | 综合上述两种谱图分析,可以得知其A的相对分子质量 | |
| D. | 若A的化学式为C2H6O,则其结构简式为CH3CH2OH |
20.还原性的无水草酸是无色无臭的透明结晶或白色粉末.草酸在浓硫酸并加热条件下容易脱去水分,分解为二氧化碳和一氧化碳.
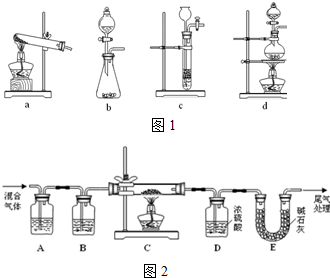
(1)草酸(H2C2O4)浓硫酸并加热条件下分解的化学方程式为:H2C2O4 $\frac{\underline{\;浓硫酸\;}}{△}$CO↑+CO2↑+H2O下列装置中如图1,可用于草酸分解制取气体的是d.(填字母)
(2)某探究小组利用草酸分解产生的混合气体和铁锈反应来测定铁锈样品组成(假定铁锈中只有Fe2O3•nH2O和Fe两种成份),实验装置如下图2所示,请回答:
①为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的试剂分别是浓NaOH溶液、浓硫酸.
②在点燃酒精灯之前应进行的操作是:(a)检查装置气密性(或先排尽装置内空气,以防止加热时发生爆炸);(b)通入混合气体一段时间.
③准确称量样品的质量10.00g置于硬质玻璃管中,充分反应后冷却、称量,硬质玻璃管中剩余固体质量为8.32g,D中浓硫酸增重0.72g,则n=2(假定Fe和H2O不发生反应,实验过程中每步均完全吸收或反应).
④在本实验中,下列情况会使测定结果n偏大的是abc(填字母).
a.缺少洗气瓶B b.缺少装置E
c.反应后固体是铁和少量Fe2O3 d.反应后固体是铁和少量Fe2O3•nH2O
(3)该探究小组还利用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.
①请完成以下实验设计表(表中不要留空格):
每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL,催化剂MnSO4的用量可选择0.5g、0.0g)
②若要准确计算反应速率,该实验中还需测定溶液紫色消失所需要的时间.请你设计出通过测定褪色时间长短来判断浓度大小与反应速率关系的实验方案:
取过量的体积相同、浓度不同的草酸溶液分别同时与体积相同、浓度相同的高锰酸钾酸性溶液反应.
③写出KMnO4酸性溶液与H2C2O4溶液反应的离子方程式:2MnO4_+5H2C2O4+6H+=10CO2↑+8H2O+2Mn2+.

(1)草酸(H2C2O4)浓硫酸并加热条件下分解的化学方程式为:H2C2O4 $\frac{\underline{\;浓硫酸\;}}{△}$CO↑+CO2↑+H2O下列装置中如图1,可用于草酸分解制取气体的是d.(填字母)
(2)某探究小组利用草酸分解产生的混合气体和铁锈反应来测定铁锈样品组成(假定铁锈中只有Fe2O3•nH2O和Fe两种成份),实验装置如下图2所示,请回答:
①为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的试剂分别是浓NaOH溶液、浓硫酸.
②在点燃酒精灯之前应进行的操作是:(a)检查装置气密性(或先排尽装置内空气,以防止加热时发生爆炸);(b)通入混合气体一段时间.
③准确称量样品的质量10.00g置于硬质玻璃管中,充分反应后冷却、称量,硬质玻璃管中剩余固体质量为8.32g,D中浓硫酸增重0.72g,则n=2(假定Fe和H2O不发生反应,实验过程中每步均完全吸收或反应).
④在本实验中,下列情况会使测定结果n偏大的是abc(填字母).
a.缺少洗气瓶B b.缺少装置E
c.反应后固体是铁和少量Fe2O3 d.反应后固体是铁和少量Fe2O3•nH2O
(3)该探究小组还利用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.
①请完成以下实验设计表(表中不要留空格):
每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL,催化剂MnSO4的用量可选择0.5g、0.0g)
②若要准确计算反应速率,该实验中还需测定溶液紫色消失所需要的时间.请你设计出通过测定褪色时间长短来判断浓度大小与反应速率关系的实验方案:
| 实验 编号 | 实验目的 | T/K | 催化剂用量/g | c/mol•l-1 | |
| KMnO4 | H2C2O4 | ||||
| Ⅰ | 为以下实验作参考 | 298 | 0.5 | 0.01 | 0.1 |
| Ⅱ | 探究KMnO4酸性溶液的浓度对该反应速率的影响 | 298 | 0.5 | 0.001 | 0.1 |
| Ⅲ | 323 | 0.5 | 0.01 | 0.1 | |
| Ⅳ | 探究催化剂对反应速率的影响 | 0.1 | |||
③写出KMnO4酸性溶液与H2C2O4溶液反应的离子方程式:2MnO4_+5H2C2O4+6H+=10CO2↑+8H2O+2Mn2+.
17.100mL6mol/L的硫酸跟过量锌粉反应,在一定温度下,为了减缓反应速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
①硫酸钠固体 ②水 ③硫酸钾溶液 ④硝酸钾溶液 ⑤CuSO4溶液.
①硫酸钠固体 ②水 ③硫酸钾溶液 ④硝酸钾溶液 ⑤CuSO4溶液.
| A. | ①②⑤ | B. | ①④ | C. | ②③ | D. | ③④⑤ |
1.下列叙述正确的是( )
| A. | 甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色 | |
| B. | 有机物  的消去产物只有1种 的消去产物只有1种 | |
| C. | 有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2=CH-COOCH3 | |
| D. | 可用溴水鉴别已烯、四氯化碳和乙酸 |
18.常见的无机酸25℃时在水溶液中的电离平衡常数如表:
下列选项正确的是( )
| 氢氰酸(HCN) | 碳酸(H2C03) | 氢氟酸(HF) |
| K=6.2×10-10 | K=4.2×10-7 | K=6.61×10-4 |
| A. | 氟化钠溶液中通入C02:2F-+H20+C02═2HF+CO32- | |
| B. | NaCN与HCN的混合溶液中:2c(Na+)═c(CN-)+c(HCN) | |
| C. | 25℃时同浓度的NaCN和NaF溶液的pH值前者小于后者 | |
| D. | 25℃时CN-的水解平衡常数约为1.6×10-5 |
19.下列说法正确的是( )
| A. | 在含FeCl2杂质的FeCl3溶液中通足量Cl2后,即可得到较纯净的FeCl3溶液 | |
| B. | 除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 | |
| C. |  准确量取9.50mL水 准确量取9.50mL水 | |
| D. | 1 mol 羟基中电子数为10NA |
 某同学欲用CCl4萃取较高浓度的碘水中的碘,操作过程可以分解为如下几步:
某同学欲用CCl4萃取较高浓度的碘水中的碘,操作过程可以分解为如下几步: