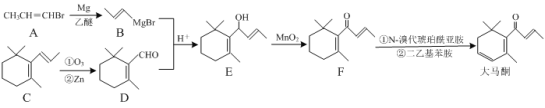
题目内容
【题目】经研究光化学烟雾和酸雨的形成都与氮氧化物有关。人们研究了诸多有关氮氧化物的性质,请回答下列问题:
(1)处理NOx的一种方法是利用甲烷催化还原NOx。
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) K1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) K2
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) K3
K1、K2、K3依次为三个反应的平衡常数,则K3=______________(用K1、K2表示)
(2)在恒容密闭容器中通入等物质的量的CO和NO,在一定条件下发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g),△H,测得NO的平衡转化率与温度及压强的关系如图所示:
N2(g)+2CO2(g),△H,测得NO的平衡转化率与温度及压强的关系如图所示:
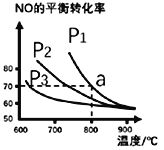
②对于气相反应,用某组分(B)的平衡分压强p(B)代替物质的量浓度c(B)也可表示平衡常数kp,求a点的平衡常数kp=_________(MPa)1(列出计算式,分压=总压×物质的量分数)。
③为探究速率与浓度的关系,该实验中,根据相关实验数据,粗略绘制了两条速率-浓度关系曲线:υ正~c(NO)和υ逆~c(CO2)

则:与曲线υ正~c(NO)相对应的是图中曲线___________ (填“甲”或“乙”)。当降低反应体系的温度,反应一段时间后,重新达到平衡,CO2和NO相应的平衡点分别为______(填字母)。
(3)利用电化学原理,将NO2、O2和熔融的KNO3制成燃料电池,模拟工业电解法来处理含Cr2O72-的废水,如图所示。电解过程中溶液发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
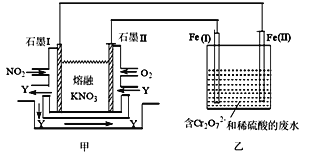
①甲电池工作时,Y是气体,可循环使用。则石墨I附近发生的电极反应式为___________。乙池中的pH________(填“变大”“变小”或“不变”)。
②工作时,在相同条件下,甲池内消耗的O2和NO2的体积比为________。
(4)已知H3PO4为三元酸,Ka1=7.0×10-3 mol·L-1,Ka2=6.2×10-8mol·L-1,Ka3=4.5×10-13mol·L-1。则Na2HPO4水溶液呈________ (填“酸”、“中”、“碱”)性,用Ka与Kh的相对大小,说明判断理由_____________________。
【答案】![]()
 乙 H;D NO2 +NO3- - e-= N2O5 变大 1:4 碱 Na2HPO4水解常数为
乙 H;D NO2 +NO3- - e-= N2O5 变大 1:4 碱 Na2HPO4水解常数为![]() =1.61×10-7>Ka3=4.5×10-13mol·L-1
=1.61×10-7>Ka3=4.5×10-13mol·L-1
【解析】
(1)利用方程式相加,K相乘,方程式除以2,K开方得到。
(2)建立三段式建立关系,进行计算。
③开始时υ逆~c(CO2)为0,得出曲线υ正~c(NO)相对应的曲线,利用该反应为放热反应,当降低反应体系的温度,速率降低,平衡正向移动得出重新达到平衡时CO2、NO平衡点。
(3)①石墨I发生氧化反应,化合价升高,得出石墨I附近发生的电极反应式,乙池中不断消耗氢离子,得出溶液的pH变化。
②在相同条件下,根据化合价升高相等得到甲池内消耗的O2和NO2的体积比。
(4)根据Na2HPO4水解常数与电离平衡常数比较得出溶液酸碱性。
(1)将第1个方程加第2个方程,再除以2,得到第3个方程,而平衡常数为方程式相加,K相乘,方程式除以2,则K开方,因此K3=![]() ,故答案为:
,故答案为:![]() 。
。
(2)设CO和NO物质的量为2mol,则有
2CO(g) + 2NO(g)![]() N2(g) + 2CO2(g)
N2(g) + 2CO2(g)
开始:2mol 2mol 0 0
转化:1.4mol 1.4mol 0.7mol 1.4mol
平衡:0.6mol 0.6mol 0.7mol 1.4mol
②a点的平衡常数 ,故答案为:
,故答案为: 。
。
③开始时υ逆~c(CO2)为0,因此曲线υ正~c(NO)相对应的是图中曲线乙,根据第1个图得出,升温,NO的平衡转化率降低,则平衡逆向移动,反应为放热反应,当降低反应体系的温度,速率降低,平衡正向移动,重新达到平衡,CO2平衡点为H,NO平衡点为D, 答案为:乙;H;D。
(3)①石墨I发生氧化反应,化合价升高,石墨I附近发生的电极反应式为NO2 +NO3- - e-= N2O5;乙池中Fe(I)为阳极,电极反应式为Fe-2e-=Fe2+,Fe(II)为阴极,电极反应式为2H++2e-=H2↑,溶液中发生反应Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,不断消耗氢离子,因此溶液的pH变大,故答案为:NO2 +NO3- - e-= N2O5,变大。
②甲池中石墨(I)电极反应式为NO2 +NO3- - e-= N2O5,石墨(II)电极反应式为O2+4e-+2N2O5=4NO3-,在相同条件下,根据电子守恒相等,甲池内消耗的O2和NO2的体积比为1:4,故答案为1:4。
(4)已知H3PO4为三元酸,Ka1=7.0×10-3 mol·L-1,Ka2=6.2×10-8mol·L-1,Ka3=4.5×10-13mol·L-1,Na2HPO4水解常数为![]() =1.61×10-7>Ka3=4.5×10-13mol·L-1,因此HPO4-的水解程度大于电离程度,Na2HPO4水溶液呈碱性,故答案为:碱;Na2HPO4水解常数为
=1.61×10-7>Ka3=4.5×10-13mol·L-1,因此HPO4-的水解程度大于电离程度,Na2HPO4水溶液呈碱性,故答案为:碱;Na2HPO4水解常数为![]() =1.61×10-7>Ka3=4.5×10-13mol·L-1。
=1.61×10-7>Ka3=4.5×10-13mol·L-1。