题目内容
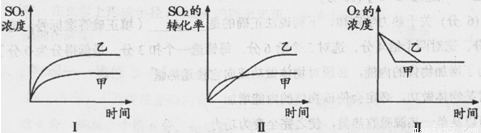
| A.N2、H2的转化率不相等 |
| B.平衡时,H2与NH3的生成速率之比为3:2 |
| C.x:y=1:3 |
| D.x的取值范围为0<x<0.14 |
B、反应过程中和平衡状态下化学反应中 物质反应速率之比等于化学方程式的计量数之比,平衡时,H2与NH3的生成速率之比为3:2,故B正确;
C、依据A选项分析可知,反应物的起始量之比为1:3,即x:y=1:3,故C正确;
D、依据极值转化始转平,平转始,得到氮气的物质的量取值范围,假设反应正向进行
N2+3H2?2NH3
起始量(mol) x y z
变化量(mol) x-0.1 y-0.3 0.08-z
平衡量(mol) 0.1 0.3 0.08
若正向进行彻底,氮气物质的量全部转化,物质的量为0;若反应逆向进行彻底,氮气物质的量为0.14mol,氨气为0,但反应是可逆反应不可能进行彻底,得到氮气的物质的量为
0<n(N2)<0.14mol,故D正确;
故选A.

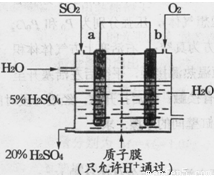
工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下:
|


 (1)己知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式:______________________________________________;当温度升高时,该反应的平衡常数K值___________(填“增大”、“减小”或“不变”)。
(1)己知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式:______________________________________________;当温度升高时,该反应的平衡常数K值___________(填“增大”、“减小”或“不变”)。
(2)硝酸厂尾气常用的处理方法是催化还原法:催化剂存在时用H2将NO2还原为N2 。已知:
2H2(g)+O2(g)=2H2O(g) △H= a kJ·mol-1
N2(g)+2O2(g)=2NO2(g) △H= b kJ·mol-1
H2O(1)=H2O(g) △H= c kJ·mol-1
则反应2NO2(g)+4H2(g)=N2(g)+4H2O(1)的△H=_________。(用a、b、c表示)
(3)①合成氨反应的化学方程式为N2+3H2 2NH3,该反应在固定容积的密闭容器中进行。下列各项标志着该反应达到化学平衡状态的是____________(填序号)
2NH3,该反应在固定容积的密闭容器中进行。下列各项标志着该反应达到化学平衡状态的是____________(填序号)
A.容器内N2、H2、NH3的浓度之比为1∶3∶2
B.3v正(N2)=v逆(H2)
C.容器内压强保持不变
D.混合气体的相对分子质量保持不变
E.1mol N≡N键断裂,同时1mol H—H键断裂
②若在恒温条件下,将N2与H2按一定比例混合通入一个容积为2L的密闭容器中,5min反应达平衡,n(N2)=1mol,n(H2)=1mol,n(NH3)=2mol,则反应速率v(N2)=________________,H2的平衡转化率=_________________;若保持容器的温度不变,在10min时将容器的容积压缩为lL,请在答题卡坐标图中,画出从反应开始至15min时c(NH3)随时间变化曲线示意图。


 (2010?聊城模拟)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
(2010?聊城模拟)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤. 2SO3(g) △H=-197 kj/mol。开始时在10 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出197kJ的热量,该温度下的平衡常数K= ,升高温度K将 (填“增大、减小或不变”)。
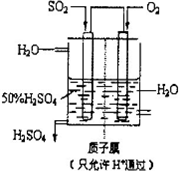
2SO3(g) △H=-197 kj/mol。开始时在10 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出197kJ的热量,该温度下的平衡常数K= ,升高温度K将 (填“增大、减小或不变”)。 2SO3(g),化学兴趣小组的同学探究了其他条件不变时,改变某一条件时对上述反应的影响,并根据实验数据作出了下列关系图。下列判断中正确的是 (填字母)。
2SO3(g),化学兴趣小组的同学探究了其他条件不变时,改变某一条件时对上述反应的影响,并根据实验数据作出了下列关系图。下列判断中正确的是 (填字母)。