题目内容
【题目】探究金属与过量浓硫酸反应的装置(固定装置已略去)如下图所示。关于实验操作或叙述错误的是
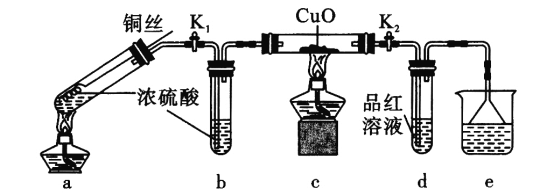
A.上下抽动铜丝,可控制反应随时发生或停止
B.e中可以选用NaOH溶液或酸性KMnO4溶液
C.其他条件不变,用铁丝代替铜丝,c、d中两次实验现象相同
D.为确定a中白色固体是否是硫酸铜,可向冷却后的试管中注入水,振荡后观察现象
【答案】D
【解析】
由实验装置,a装置中铜丝与浓硫酸加热,发生反应Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O,装置b中的浓硫酸可除去水蒸气,c装置中黑色的CuO固体颜色无明显变化,说明没有H2产生,SO2能使品红溶液褪色,所以d装置中品红溶液红色褪去,e为尾气处理装置,据此分析解答。
A.上下抽动铜丝,可控制浓硫酸与铜丝接触与否,从而控制反应的发生与停止,A选项正确;
B.e为尾气处理装置,用于吸收SO2,SO2是酸性气体,具有还原性,可用NaOH溶液或酸性KMnO4溶液吸收,B选项正确;
C.用铁丝代替铜丝,其他条件不变,铁丝与浓硫酸加热仍然产生SO2,不产生氢气,则c、d中两次实验现象相同,C选项正确;
D.装置a中反应后的溶液中含有浓硫酸,所以确定a中白色固体是否是硫酸铜时,应将a装置中试管内冷却的混合物沿杯壁缓缓倒入盛有水的烧杯中,并不断搅拌,观察溶液是否变蓝,D选项错误;
答案选D。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案【题目】常温下,1mol化学键断裂形成气态原子所需要的能量用![]() 表示。结合表中信息判断下列说法不正确的是( )
表示。结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ/mol) | 436 | 157 | 568 | 432 | 298 |
A. 432kJ/mol>E(H-Br)>298kJ/mol B. 表中最稳定的共价键是H-F键
C. H2(g)→2H(g) △H=+436kJ/mol D. H2(g)+F2(g)=2HF(g) △H=-25kJ/mol
【题目】已知常温下浓度为0.1mol/L的几种溶液的pH如右下表。下列有关说法正确的是( )
溶质 | pH |
NaF | 7.5 |
Na2CO3 | 11.6 |
NaClO | 9.7 |
NaHCO3 | 8.3 |
A. 同温度同浓度下,酸由强到弱的顺序为:HF>H2CO3>HClO
B. 水解方程式:F-+H2O![]() HF+OH-的平衡常数为1×10-13
HF+OH-的平衡常数为1×10-13
C. 将CO2通入0.lmol/LNa2CO3溶液至溶液呈中性,则溶液中:2c(CO32-)+c(HCO3-)=0.1mol/L
D. 等物质的量的NaF和HF混合溶液中粒子浓度大小关系为:c(HF)>c(Na+)>c(F-)>c (H+)>c(OH-)