题目内容
【题目】常温下,1mol化学键断裂形成气态原子所需要的能量用![]() 表示。结合表中信息判断下列说法不正确的是( )
表示。结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ/mol) | 436 | 157 | 568 | 432 | 298 |
A. 432kJ/mol>E(H-Br)>298kJ/mol B. 表中最稳定的共价键是H-F键
C. H2(g)→2H(g) △H=+436kJ/mol D. H2(g)+F2(g)=2HF(g) △H=-25kJ/mol
【答案】D
【解析】
A.依据溴原子半径大于氯原子小于碘原子,原子半径越大,相应的化学键的键能越小分析,所以结合图表中数据可知432 kJ/mol>E(H-Br)>298 kJ/mol,A正确;
B.键能越大,断裂该化学键需要的能量就越大,形成的化学键越稳定,表中键能最大的是H-F,所以最稳定的共价键是H-F键,B正确;
C.氢气变化为氢原子吸热等于氢气中断裂化学键需要的能量,H2→2H(g)△H=+436 kJ/mol,C正确;
D.依据键能计算反应焓变=反应物键能总和-生成物键能总和计算判断,△H=436kJ/mol+157kJ/mol-2×568kJ/mol=-543kJ/mol,H2(g)+F2(g) =2HF(g),△H=-543 kJ/mol ,D错误;
故合理选项是D。

 名校课堂系列答案
名校课堂系列答案【题目】I.明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:

已知生成氢氧化物沉淀的pH如下表所示:
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀 | 3.4 | 6.3 | 1.5 |
完全沉淀 | 4.7 | 8.3 | 2.8 |
回答下列问题:
(1)明矾净水的原理是______________________________(用离子方程式表示)。
(2)操作Ⅱ是_______________、_________________、过滤、洗涤、干燥。
(3)检验滤液A中是否存在Fe2+的方法______________________________ (只用一种试剂)。
(4)在滤液A中加入高锰酸钾发生反应的离子方程式为:__________。
(5)调节pH=3的目的是_______________________ ,滤渣2含有的物质是______。
II.(6)取一定量含有Pb2+、Cu2+的工业废水,向其中滴加Na2S溶液,当PbS开始沉淀时,溶液中c(Pb2+)/c(Cu2+) =_________ (保留三位有效数字)。[已知Ksp(PbS)=3.4×10-28,
Ksp(CuS)=1.3×10-36]
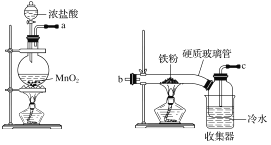
【题目】氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间歇法”制取。反应原理、实验装置图(加热装置都已略去)如下:![]() +Cl2
+Cl2![]()
![]() +HCl
+HCl 
已知:氯苯为无色液体,沸点132.2 ℃。
回答下列问题:
(1)A反应器是利用实验室法制取氯气,中空玻璃管B的作用是______。
(2)把干燥的氯气通入装有干燥苯的反应器C中(内有相当于苯量1%的铁屑作催化剂),加热维持反应温度在40~60 ℃为宜,温度过高会生成二氯苯。
①对C加热的方法是________(填字母)。
a.酒精灯加热 b.油浴加热 c.水浴加热
②D出口的气体成分有HCl、________和________。
(3)C反应器反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏。碱洗之前要水洗的目的是洗去部分无机物,同时减少碱的用量,节约成本。写出用10%氢氧化钠碱洗时可能发生的化学反应方程式:_____________、__________(写两个即可)。
(4)上述装置图中A、C反应器之间,需要增添一个U形管,其内置物质是________。
(5)工业生产中苯的流失情况如下:
项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
苯流失量(kg·t-1) | 13 | 24.9 | 51.3 | 89.2 |
则1 t苯可制得成品为________t(只要求列式)。
【题目】铵盐是比较重要的盐类物质,请回答下列问题:
(1)氯化铵溶液可以清洗铁器表面锈迹,写出相关反应的离子方程式:_________________
(2)实验表明氢氧化镁可溶于氯化铵溶液中,两个观点:氯化铵水解显酸性中和OH-,使氢氧化镁沉淀溶解平衡正移;铵根结合OH-,使氢氧化镁沉淀溶解平衡正移。为了探究反应机理,可向溶液中加入_____盐溶液验证。
(3)NH4SCN溶液与AgNO3溶液反应会生成 AgSCN沉淀。已知:室温下,Ksp(AgCl)=1.8×10-10,Ksp(AgSCN)= 2.0×10-12,则AgCl转化为AgSCN的平衡常数K=____________
(4)常温下向100mL0.2mo/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。

①表示NH3·H2O浓度变化的曲线是__________(填“A”或“B")。
②NH3·H2O的电离常数为__________________(已知lg1.8 = 0.26)。
③当加入盐酸体积为50mL时,溶液中c(NH4+)-c(NH3·H2O) =_____mol/L (用数字表示)。
(5)为了探究外界条件对氯化铵水解平衡的影响,设计如下实验方案:
实验序号 | c(NH4Cl)/mol.L-1 | 温度/℃ | 待测物理量 | 实验目的 |
Ⅰ | 0.5 | 30 | x | - |
Ⅱ | 1.5 | i | y | 探究浓度对氯化铵水解平衡的影响 |
Ⅲ | 0.5 | 35 | z | ii |
Ⅳ | 2.0 | 40 | m | 探究温度、浓度同时对氯化铵水解平衡的影响 |
限选药品和仪器:恒温水浴、pH计、烧杯、0.1mol.L-1硝酸银溶液、蒸馏水和各种浓度的NH4Cl溶液.
①实验中,“待测物理量”是_______________
②i=____________________;ii:___________________________________
③上述表格中,y____(填“>”“<”或“=”)m.