题目内容
6.锆(Zr)元素是核反应堆燃料棒的包裹材料,二氧化锆(ZrO2)可以制造耐高温纳米陶瓷.我国有丰富的锆英石(ZrSiO4)含Al2O3、SiO2、Fe2O3等杂质,碱熔法生产锆的流程如下:
已知25℃时部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 | Zr(OH)4 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀时pH | 1.2 | 2.7 | 3.4 | 6.3 |
| 完全沉淀时pH | 2.4 | 3.2 | 5.2 | 9.7 |
ZrSiO4+4NaOH=Na2ZrO3+Na2SiO3+2H2O
(2)为了提高浸出率可采取的方法有将原料粉碎增大接触面积、加热或搅拌或多次浸取(列举两种)
(3)生成滤渣2的成分H2SiO3 或 H4SiO4(用化学式表示)
(4)用氨水将滤液2的pH调至2.4≤pH<3.4,目的是使Zr4+完全转化为Zr(OH)4沉淀,同时保证Al3+不会被沉淀下来.
(5)往流程中滤渣1中加入盐酸溶液,过滤不溶物后,再将滤液在不断通入HCl气流中气流同时蒸发结晶,可回收得到铁的氯化物FeCl3晶体.
分析 锆英砂(主要成分为ZrSiO4,也可表示为ZrO2•SiO2,还含少量Fe2O3、Al2O3、SiO2等杂质)加NaOH熔融,二氧化硅反应转化为硅酸钠,ZrSiO4转化为Na2SiO3和Na2ZrO3,氧化铝和氢氧化钠反应生成偏铝酸钠,水浸过滤,滤渣1为Fe2O3,得到滤液1中加过量盐酸酸浸,Na2SiO3与HCl生成硅酸沉淀,偏铝酸钠和过量盐酸反应得到氯化铝,滤渣2为H2SiO3,滤液中含有ZrO2+、Al3+,加氨水调节pH为2.4~2.7使ZrO2+转化为Zr(OH)4沉淀,过滤、洗涤,得到Zr(OH)4,加热分解,即可得到ZrO2;
(1)高温下,ZrSiO4与NaOH反应生成Na2SiO3和Na2ZrO3;
(2)结合影响化学反应速率的因素分析,增大浓度、升高温度、增大接触面积、搅拌、多次浸取等分析;
(3)分析可知滤渣2为硅酸沉淀;
(4)根据表中数据判断;加氨水至pH=2.4时,ZrO2+与NH3•H2O反应生成Zr(OH)4沉淀;
解答 解:(1)高温下,ZrSiO4与NaOH反应生成Na2SiO3和Na2ZrO3,反应的化学方程式为:ZrSiO4+4NaOH=Na2ZrO3+Na2SiO3+2H2O,
故答案为:ZrSiO4+4NaOH=Na2ZrO3+Na2SiO3+2H2O;
(2)为了提高浸出率可采取的方法有,将原料粉碎增大接触面积、加热、搅拌、多次浸取,
故答案为:原料粉碎增大接触面积、加热或搅拌或多次浸取;
(3)二氧化硅反应转化为硅酸钠,ZrSiO4转化为Na2SiO3和Na2ZrO3,氧化铝和氢氧化钠反应生成偏铝酸钠,水浸过滤,滤渣1为Fe2O3,得到滤液1中加过量盐酸酸浸,偏铝酸钠和过量盐酸反应得到氯化铝,Na2SiO3与HCl生成硅酸沉淀,滤渣2为H2SiO3或 H4SiO4,
故答案为:H2SiO3 或 H4SiO4;
(4)滤液2中含有ZrO2+、Al3+,依据图表数据分析可知,加氨水调节pH为2.4~2.7使ZrO2+转化为Zr(OH)4沉淀,铝离子不沉淀,过滤、洗涤,得到Zr(OH)4,加热分解,即可得到ZrO2;
故答案为:2.4≤pH<3.4,使Zr4+完全转化为Zr(OH)4沉淀,同时保证Al3+不会被沉淀下来;
(5)滤渣1为Fe2O3,加入盐酸溶液,过滤不溶物后得到滤液为氯化铁溶液,再将滤液在不断通入HCl气流中蒸发结晶,防止氯化铁水解生成氢氧化铁沉淀,这样可回收得到铁的氯化物FeCl3晶体,
故答案为:HCl气流中.
点评 本题考查了物质提纯、分离方法和实验过程分析判断,主要是离子性质、物质分离的应用,注意沉淀离子的溶液PH数据分析,掌握基础是解题关键,题目难度中等.

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案 如图表示反应X(g)?4Y(g)+Z(g)△H<0,在某温度时X的浓度随时间变化的曲线,下列有关该反应的描述正确的是( )
如图表示反应X(g)?4Y(g)+Z(g)△H<0,在某温度时X的浓度随时间变化的曲线,下列有关该反应的描述正确的是( )| A. | X的平衡转化率为85% | |
| B. | 第6 min 后,反应就终止了 | |
| C. | 若升高温度,X的平衡转化率将大于85% | |
| D. | 若降低温度,v正减小,v逆增大 |
| A. | M的单质可用于从钛、锆等金属的氯化物溶液中置换出钛、锆等单质 | |
| B. | 由X、Y、Z三种元素形成的某种化合物的水溶液,可能呈碱性或酸性 | |
| C. | 由X、M与Z形成的化合物X2Z2和M2Z2中所含的化学键类型相同 | |
| D. | 含有W阳离子的某种盐,可用作净水剂 |
| A. | 由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低 | |
| B. | 由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高 | |
| C. | 由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低 | |
| D. | 由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高 |
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 废弃的电池应分类回收,不要随意丢弃.否则,既造成浪费又污染环境 | |
| C. | PM2.5(2.5微米以下的颗粒物)的污染与化石燃料的燃烧关系不大 | |
| D. | 氢能是清洁能源,工业上电解水法制大量氢气符合节能减排理念 |
| A. | 17 g | B. | 5.1 g | C. | 10.2 g | D. | 34 g |
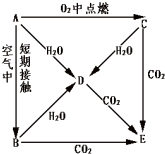 A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,己知A金属为单质.
A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,己知A金属为单质.
