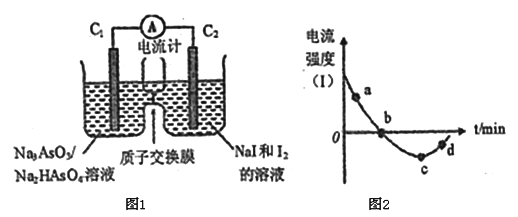
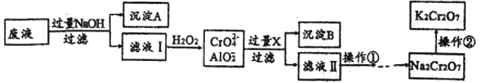
题目内容
【题目】浓差电池中的电动势是由于电池中存在浓度差而产生的。某浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能。下列有关该电池的说法错误的是

A. 电池工作时,Li+通过离子电子导体移向b区
B. 电流由X极通过外电路移向Y极
C. 正极发生的反应为:2H++2e-=H2↑
D. Y极每生成1 mol Cl2,a区得到2 mol LiCl
【答案】A
【解析】加入稀盐酸,在X极(正极)上生成氢气,发生还原反应,电极方程式为2H++2e-=H2↑,为正极反应,Y极生成Cl2,为负极反应,发生2Cl--2e-=Cl2↑,原电池中电流从正极流向负极,阳离子向正极移动,则A.电池工作时,Li+向正极a上移动,A错误;B.电流由正极X极通过外电路移向负极Y极,B正确;C.在X极(正极)上生成氢气,发生还原反应,电极方程式为2H++2e-=H2↑,C正确;D.Y极每生成1 mol Cl2,则转移2mol电子,有2molLi+向正极移动,则a区得到2 mol LiCl,D正确,答案选A。

练习册系列答案
相关题目
【题目】两个容积均为10L的密闭容器Ⅰ和Ⅱ中发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),起始物质的量见下表。实验测得两容器不同温度下达到平衡时CO2的物质的量浓度如下图所示,下列说法错误的是
N2(g)+2CO2(g),起始物质的量见下表。实验测得两容器不同温度下达到平衡时CO2的物质的量浓度如下图所示,下列说法错误的是

容器 | 起始物质的量 | ||
NO | CO | ||
Ⅰ | 1mol | 0.5mol | |
Ⅱ | 2mol | 1mol | |
A. 反应N2(g)+2CO2(g)![]() 2NO(g)+2CO(g)的ΔH<0,ΔS>0
2NO(g)+2CO(g)的ΔH<0,ΔS>0
B. P点的速率比M点慢
C. M、N两点容器内的压强: P(M) <2P(N)
D. N点的平衡常数为44.4