题目内容
【题目】已知:A酸的溶液pH=a,B碱的溶液pH=b
(1)若A为盐酸,B为氢氧化钡,且a+b=14,两者等体积混合,溶液的pH=____。酸碱按体积比为1:10混合后溶液显中性,则a+b=____________。
(2)若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为__________mo1·L–l,B溶液中水电离出的氢离子浓度为____________mol·L–1。
(3)若A为醋酸,B为氢氧化钠,且a+b=14,用体积为VA的醋酸和体积为VB的氢氧化钠溶液混合后,溶液显中性,则其体积关系VA _____________VB,混合后溶液中的离子浓度关系为c(Na+)___________c(CH3COO-)。
(4)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为_________________。
【答案】7 13 10-10 10-12 < = M++H2O![]() MOH+H+
MOH+H+
【解析】
A溶液中的c(H+)=10-amol·L-1,B溶液中的c(H+)=10-bmol·L-1,B溶液中的c(OH-)=10b-14mol·L-1
(1)盐酸是强酸,氢氧化钡是强碱,a+b=14时,若a=1,则b=13,两溶液等体积混合,溶液呈中性,即pH=7;若酸碱体积比为1:10,则有1×10-a=10×10b-14,即-a=b-14+1,即a+b=13;
(2)若A为醋酸,A溶液中的H+主要来自于醋酸的电离,则水电出的H+的浓度与OH-的浓度相同,都是![]() =
=![]() =10-10mol/L;B为氢氧化钠,溶液中H+主要来自于水的电离,其浓度为10-bmol/L=10-12mol/L;
=10-10mol/L;B为氢氧化钠,溶液中H+主要来自于水的电离,其浓度为10-bmol/L=10-12mol/L;
(3)醋酸是弱酸,氢氧化钠是强碱,a+b=14,则a=b-14,即醋酸溶液中H+的浓度和氢氧化钠溶液中OH-的浓度相同;若两种溶液等体积混合,则混合后溶液呈酸性,所以要想使溶液呈中性,要适当减少酸的体积或增加碱的体积,即VA<VB;根据电荷守恒,有c(Na+)+c(H+)=c(OH-)+c(CH3COO-),由于溶液呈中性,即c(H+)=c(OH-),所以c(Na+)=c(CH3COO-);
(4)由于a+b=14,则a=b-14,即HR溶液中H+的浓度和MOH溶液中OH-的浓度相同;两者等体积混合后,溶液呈碱性,则MOH一定是弱碱,HR可能是强酸,也可能是弱酸(但HR电离常数要大于MOH),由于必定有一种离子发生水解,所以该离子一定是M+,其水解的离子方程式为:M++H2O![]() MOH+H+。
MOH+H+。

【题目】为测定CO2的相对分子质量,某实验小组三位同学选用含NaHCO3的样品(质量均为m1g)和其它合理的试剂,进行了以下三个实验。完成下列填空:
甲用重量法确定CO2的质量,装置如下图:

(1)B中反应的化学方程式为____________________________________________________。
(2)实验中持续缓缓通入空气,其作用之一是把生成的CO2全部排入后续装置中,使之完全被吸收;另有作用为___________________________________________________________。
(3)不能提高测定精确度的措施是___________。
a.向B内加入酸之前,排尽装置内的CO2气体
b.向B内滴加酸时不宜过快
c.在B、C之间增添盛有饱和NaHCO3溶液的洗气装置
d.在D后增添盛有碱石灰的干燥管
乙用滴定法确定CO2的物质的量,将样品配制成100mL溶液,从中取出20.00 mL,用c mol·L-1的盐酸滴定(甲基橙作指示剂)。当______________________________________________________时,停止滴定。平行测定三次,有关实验数据记录如下表。m1 g样品产生CO2的物质的量为_____________。
实验编号 | 待测液体积 (mL) | 消耗盐酸体积(mL) | |
初读数 | 末读数 | ||
1 | 20.00 | 0.00 | 25.02 |
2 | 20.00 | 0.20 | 28.80 |
3 | 20.00 | 1.30 | 26.28 |
丙用气体体积法确定CO2的体积,装置如图所示。
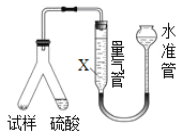
(4)为了减小实验误差,量气管中加入的液体X为___________________溶液;
(5)若该装置气密性良好,读数平视,但测得的“CO2体积”数据仍然偏小,其原因可能是____________________________________________________________________________。
(6)确定CO2的相对分子质量,选用___________________(限用“甲”、“乙”、“丙”进行填写)的实验数据为最佳。