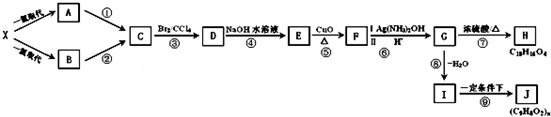
题目内容
将50ml 1mol/LNaOH溶液加水稀释到500ml,稀释后溶液中NaOH的物质的量浓度是( )
| A、0.1mol/L |
| B、0.5 mol/L |
| C、0.01mol/L |
| D、0.05 mol/L |
考点:物质的量浓度的相关计算
专题:
分析:根据稀释定律,稀释前后溶质NaOH的物质的量相等,据此计算稀释后溶液中NaOH的物质的量浓度.
解答:
解:设稀释后溶液中NaOH的物质的量浓度为c,根据稀释定律,稀释前后溶质NaOH的物质的量相等,则:
0.05L×1mol/L=0.5L×c
解得c=0.1mol/L
故选A.
0.05L×1mol/L=0.5L×c
解得c=0.1mol/L
故选A.
点评:本题考查物质的量浓度有关计算,比较基础,注意对公式的理解与灵活应用.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
据调查,劣质的家庭装饰材料会释放出近百种能引发疾病的有害物质,其中一种有机物分子的球棍模型如图,如图中“棍”代表单键或双键或三键,不同大小的球代表不同元素的原子,且三种元素位于不同的短周期.下面关于该有机物的叙述不正确的是( )

| A、有机物化学式为C2HCl3 |
| B、可由乙炔和氯化氢加成得到 |
| C、该有机物难溶于水 |
| D、分子中所有原子在同一个平面内 |
下列变化能用勒夏特列原理解释的是( )
| A、工业生产合成氨时一般选择在500℃的温度下进行 |
| B、H2、I2、HI混合气体加压后颜色变深 |
| C、合成氨时采用循环操作,可提高原料的利用率 |
| D、红棕色的NO2加压后颜色先变深再变浅 |
下列四组物质间的反应,有一组反应中的水与其他三组有本质不同的是( )
| A、Cl2+H2O═HCl+HclO |
| B、2F2+2H2O═4HF+O2 |
| C、3NO2+H2O═2HNO3+NO |
| D、2Na2O2+2H2O═4NaOH+O2↑ |
X、Y、Z是分别位于不同周期的三种短周期元素,且原子序数逐渐增大,X、Z属于同一主族,三种元素可以形成原子个数比为1:1:1的化合物W.下列推测正确的是( )
| A、元素Z的氧化物一定属于碱性氧化物 |
| B、原子半径关系是:X<Y<Z |
| C、三种元素中,Y的金属性最强 |
| D、Y、Z都能形成含氧酸,且前者的酸性比后者酸性强 |
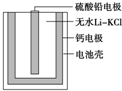 如图为一种热激活电池的基本结构,该电池总反应为PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.作为电解质的无水LiClKCl混合物受热熔融后,电池即可瞬间输出电能.下列有关说法正确的是( )
如图为一种热激活电池的基本结构,该电池总反应为PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.作为电解质的无水LiClKCl混合物受热熔融后,电池即可瞬间输出电能.下列有关说法正确的是( )| A、正极反应式:Ca+2Cl-+2e-═CaCl2 |
| B、放电过程中,Li+向负极移动 |
| C、每转移0.1mol电子,理论上生成20.7gPb |
| D、常温时,在正负极间接上电流表或检流计,指针不偏转 |
与4.4g二氧化碳所含原子数相同的一氧化碳的质量是( )
| A、1.5 g |
| B、3.0 g |
| C、4.2 g |
| D、9.0 g |
下列变化需要加入还原剂才能实现的( )
| A、KMnO4→Mn2+ |
| B、HCl→Cl2 |
| C、Fe→Fe3+ |
| D、KClO3→O2 |
 ]
]