题目内容
下列能正确表示水解的离子方程式是( )
| A、CH3COOH+H2O?CH3COO-+H3O+ |
| B、NH4++H2O?NH3?H2O+H+ |
| C、CO32-+2H2O?H2CO3+2OH- |
| D、Br-+H2O?HBr+OH- |
考点:盐类水解的原理
专题:盐类的水解专题
分析:水解反应为弱酸或弱碱离子结合水电离的氢离子或氢氧根离子生成弱电解质的反应,以此来解答.
解答:
解:A.该反应为弱酸的电离方程式,故A错误;
B.铵根离子和水反应生成弱电解质一水合氨和氢离子,为水解反应,故B正确;
C.碳酸根离子分两步水解,第一步水解方程式为CO32-+H2O?HCO3-+OH-,故C错误;
D.氢溴酸为强电解质,所以溴离子不是弱根离子,在水溶液里溴离子不水解,故D错误;
故选B.
B.铵根离子和水反应生成弱电解质一水合氨和氢离子,为水解反应,故B正确;
C.碳酸根离子分两步水解,第一步水解方程式为CO32-+H2O?HCO3-+OH-,故C错误;
D.氢溴酸为强电解质,所以溴离子不是弱根离子,在水溶液里溴离子不水解,故D错误;
故选B.
点评:本题考查了水解反应,明确水解与电离的区别是解答本题的关键,注意多元弱酸根离子分步水解,多元弱碱离子也分步水解,但多元弱碱水解写总的反应方程式,为易错点.

练习册系列答案
相关题目
设NA为阿伏加德罗常数的值,下列说法错误的是( )
| A、7.8 g Na2O2与足量的CO2反应,转移的电子数为0.2NA |
| B、36 g重氧(18O2)气体所含分子数为NA,标准状况下的体积约为22.4 L |
| C、17 g氢氧根离子含有的电子数为10NA |
| D、500 mL 0.1 mol?L-1的Al2(SO4)3溶液中,Al3+数小于0.1NA |
下列离子方程式正确的是( )
| A、碳酸氢钠的电离:NaHCO3=Na++HCO3- |
| B、将金属钠加入水中:Na+2H2O=Na++2OH-+H2↑ |
| C、硫化钠水解:S2-+2H2O=H2S↑+2OH- |
| D、向氯化铝溶液中加入过量的氨水:Al3++4OH-=Al(OH )4- |
在0.1mol/L的醋酸溶液中存在如下电离平衡:CH3COOH?CH3COO-+H+对于该平衡,下列说法正确的是( )
| A、升高温度,该溶液pH值减小 |
| B、滴加少量的0.1mol/L的盐酸溶液,平衡逆向移动,溶液中氢离子浓度减小 |
| C、加入少量的醋酸钠固体,平衡正向移动 |
| D、加水稀释,平衡正向移动,C(CH3COO-)、C(H+)变大 |
在月球上发现水被美国《科学》杂志评为2009年十大科学突破之一.下列化学反应中水作还原剂的是( )
| A、CaO+H2O=Ca(OH)2 |
| B、2Na+2H2O=2NaOH+H2↑ |
| C、Cl2+2H2O=HCl+HClO |
| D、2F2+2H2O=4HF+O2 |
常温下,某无色溶液中由水电离出来的c(H+)=1×10-12 mol?L-1,该溶液中一定能大量存在的离子组是( )
| A、Na+、K+、MnO4-、SO42- |
| B、Mg2+、NH4+、SO42-、Cl- |
| C、Na+、Cl-、NO3-、SO42- |
| D、Na+、K+、CO32-、NO3- |
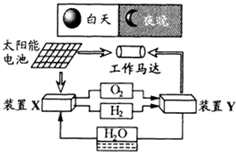 如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )
如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )| A、二氧化硅是太阳能电池的光电转换材料 |
| B、装置Y中正极的电极反应式为:O2+2H2O+4e-=4OH- |
| C、装置X能实现燃料电池的氢气和氧气再生 |
| D、装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
