题目内容
将1mol CO和1mol
![]() (气)混合,在一定条件下于密闭容器(恒容)中发生反应CO+
(气)混合,在一定条件下于密闭容器(恒容)中发生反应CO+![]() (气)
(气)![]()
![]() ,反应达平衡时,CO的转化率为83%,则平衡混合气的密度是相同条件下
,反应达平衡时,CO的转化率为83%,则平衡混合气的密度是相同条件下![]() 密度的
密度的
[ ]
A.11.5倍
B.23倍
C.30.7倍
D.46倍
答案:A

练习册系列答案
相关题目
在一定温度下,将1mol CO和1 mol水蒸气放在密闭容器中反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),达到平衡后,测得CO2为0.6mol,再通入4mol水蒸气,达到新平衡后,CO2物质的量是
CO2(g)+H2(g),达到平衡后,测得CO2为0.6mol,再通入4mol水蒸气,达到新平衡后,CO2物质的量是
[ ]
|
A.等于0.6mol |
B.等于1mol |
|
C.大于0.6mol,小于1mol |
D.小于1mol |
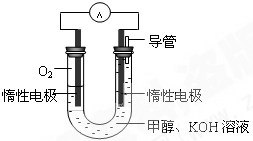 甲醇是重要的化工原料,在日常生活中有着广泛的应用.
甲醇是重要的化工原料,在日常生活中有着广泛的应用. CH3OH(g)△H1
CH3OH(g)△H1 CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2 (2013?武清区三模)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(2013?武清区三模)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.