题目内容
已知A、B、C、D、E、F、G为元素周期表中原子序数依次增大的前20号元素,A、B与C;D、E与F分别位于同一周期.A原子L层上有3个未成对电子,B的简单负二价离子与C原子核外电子排布相同、含有D元素的盐的焰色反应火焰为黄色,EF3是由活泼金属和活泼非金属组成的共价化合物,G有多种氧化物,其中一种氧化物有磁性,填写下列空白
(1)元素的第一电离能最大的是 ,属于过渡元素的是 (填写元素符号)
(2)写出B元素的基态原子价电子排布式 ,F离子电子排布式 .
(3)AF3分子中A原子的杂化类型是 ,AF3分子的几何构型为 .
(4)已知E2B3的晶格比DF的晶格能大得多,试分析导致两者晶格能差异的主要原因是: .
(5)构成G晶体的微粒是 .
(1)元素的第一电离能最大的是
(2)写出B元素的基态原子价电子排布式
(3)AF3分子中A原子的杂化类型是
(4)已知E2B3的晶格比DF的晶格能大得多,试分析导致两者晶格能差异的主要原因是:
(5)构成G晶体的微粒是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A原子L层上有3个未成对电子,原子核外电子排布为1s22s22p3,则A为N元素;A、B与C位于同一周期,B的简单负二价离子与C原子核外电子排布相同,则B为O元素、C为Ne;含有D元素的盐的焰色反应火焰为黄色,则D为Na;D、E与F分别位于同一周期,EF3是由活泼金属和活泼非金属组成的共价化合物,则E为Al、F为Cl;G有多种氧化物,其中一种氧化物有磁性,则G为Fe,
(1)氖原子是最外层为稳定结构,不易失去电子,第一电离能最大;Fe元素属于过渡元素;
(2)根据能量最低原理书写电子排布式;
(3)计算NCl3分子中N原子的价层电子对数及孤电子对数,确定杂化方式与空间构型;
(4)离子所带电荷越多、离子半径越小,晶格能越大;
(5)Fe晶体属于金属晶体,由金属阳离子与自由电子构成.
(1)氖原子是最外层为稳定结构,不易失去电子,第一电离能最大;Fe元素属于过渡元素;
(2)根据能量最低原理书写电子排布式;
(3)计算NCl3分子中N原子的价层电子对数及孤电子对数,确定杂化方式与空间构型;
(4)离子所带电荷越多、离子半径越小,晶格能越大;
(5)Fe晶体属于金属晶体,由金属阳离子与自由电子构成.
解答:
解:A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A原子L层上有3个未成对电子,原子核外电子排布为1s22s22p3,则A为氮元素;A、B与C位于同一周期,B的简单负二价离子与C原子核外电子排布相同,则B为氧元素、C为Ne;含有D元素的盐的焰色反应火焰为黄色,则D为Na;D、E与F分别位于同一周期,EF3是由活泼金属和活泼非金属组成的共价化合物,则E为Al、F为Cl;G有多种氧化物,其中一种氧化物有磁性,则G为Fe,
(1)氖原子是最外层为8电子稳定结构,不易失去电子,所以氖的第一电离能最大;Fe元素属于过渡元素,
故答案为:Ne;Fe;
(2)O元素的基态原子价电子排布式是2s22p4;Cl-的电子排布式是1s22s22p63s23p6,
故答案为:2s22p4;1s22s22p63s23p6;
(3)NCl3中N原子价层电子对数=3+
(5-1×3)=4,N原子含有1对孤电子对,故N原子采取sp3杂化,形成三角锥形结构,
故答案为:sp3;三角锥形;
(4)Al2O3晶体中Al3+、O2-的电荷大于NaCl晶体中Na+、Cl-的电荷,离子半径Al3+<Na+,O2-<Cl-,故Al2O3晶体的晶格能大于NaCl晶体的晶格能,
故答案为:Al2O3晶体中Al3+、O2-的电荷大于NaCl晶体中Na+、Cl-的电荷,而离子半径Al3+<Na+,O2-<Cl-;
(5)Fe晶体属于金属晶体,由金属阳离子与自由电子构成;
故答案为:金属阳离子、自由电子.
(1)氖原子是最外层为8电子稳定结构,不易失去电子,所以氖的第一电离能最大;Fe元素属于过渡元素,
故答案为:Ne;Fe;
(2)O元素的基态原子价电子排布式是2s22p4;Cl-的电子排布式是1s22s22p63s23p6,
故答案为:2s22p4;1s22s22p63s23p6;
(3)NCl3中N原子价层电子对数=3+
| 1 |
| 2 |
故答案为:sp3;三角锥形;
(4)Al2O3晶体中Al3+、O2-的电荷大于NaCl晶体中Na+、Cl-的电荷,离子半径Al3+<Na+,O2-<Cl-,故Al2O3晶体的晶格能大于NaCl晶体的晶格能,
故答案为:Al2O3晶体中Al3+、O2-的电荷大于NaCl晶体中Na+、Cl-的电荷,而离子半径Al3+<Na+,O2-<Cl-;
(5)Fe晶体属于金属晶体,由金属阳离子与自由电子构成;
故答案为:金属阳离子、自由电子.
点评:本题是对物质结构的考查,涉及元素推断、电离能、核外电子排布、杂化轨道、分子结构、晶格能等,推断元素是解题关键,侧重对基础知识综合应用的考查,难度中等.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
核外电子数相等的原子一定是( )
①同种元素②同种核素③质子数相同④质量数相同⑤中子数相同⑥最外层电子数相同.
①同种元素②同种核素③质子数相同④质量数相同⑤中子数相同⑥最外层电子数相同.
| A、①②③⑤ | B、①③⑥ |
| C、①③④⑥ | D、全部 |
橙花醛是一种香料,其结构简式为: .下列说法正确的是( )
.下列说法正确的是( )
 .下列说法正确的是( )
.下列说法正确的是( )| A、橙花醛不能与Br2发生加成反应 |
| B、橙花醛能发生银镜反应 |
| C、1 mol橙花醛最多可以与2 mol H2发生加成反应 |
| D、橙花醛跟乙醛等是同系物 |
下列物质能与水反应生成强酸的是( )
| A、NH3 |
| B、CO2 |
| C、SO3 |
| D、Na2O |
下列有关溶液配制说法错误的是( )
| A、称取12.5g胆矾[CuSO4?5H2O]溶于水中,并加水稀释至500mL,所得溶液物质的量浓度为0.1mol?L-1 |
| B、取58.5gNaCl固体放入1L水中充分溶解,所得溶液中NaCl的物质的量浓度为1mol?L-1 |
| C、将100g 5%的食盐水加热蒸发掉50g水后,所得溶液中NaCl的质量分数为10% |
| D、将浓度为2 mol?L-1硫酸钠溶液10mL加水稀释至200mL,所得溶液浓度为0.1mol?L-1 |
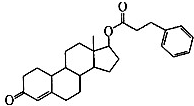 苯丙酸诺龙是一种兴奋剂,结构简式为:
苯丙酸诺龙是一种兴奋剂,结构简式为: