��Ŀ����
���ڹ�����ռ����Ҫ�ĵ�λ�����������̽����
��1��������������ˮ����ͨ�����ȵ�̿������ˮú����
C(s) + H2O(g) ![]() H2(g) + CO(g) ��H = +131.3 kJ ����S = +133.7 J/K
H2(g) + CO(g) ��H = +131.3 kJ ����S = +133.7 J/K
�÷�Ӧ�ڵ������ܷ��Է� ����ܻ��
��2����֪��400��ʱ��N2 (g)+ 3H2(g) ![]() 2NH3(g)��K=0.5,
2NH3(g)��K=0.5,
��2NH3(g)![]() N2 (g)+ 3H2(g)��K= ������ֵ����
N2 (g)+ 3H2(g)��K= ������ֵ����
��400��ʱ����0.5L�ķ�Ӧ�����н��кϳɰ���Ӧ��һ��ʱ����N2��H2��NH3�����ʵ����ֱ�Ϊ2mol��1mol��2mol�����ʱ��ӦV(N2)�� V(N2)���������������������ȷ����
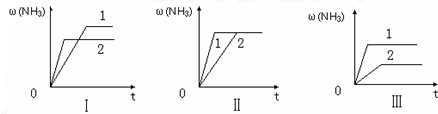
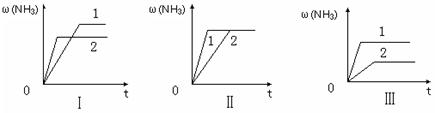
��3����������ͬ�����и�����1 molN2��3molH2����ijһ��ͬ�����·�Ӧ���ﵽƽ�⣬�������������ʱ��仯��������ͼ������˵����ȷ���� ������ţ� ��
A��ͼ������Dz�ͬѹǿ�Է�Ӧ��Ӱ�죬��P2��P1
B��ͼ������Dz�ͬѹǿ�Է�Ӧ��Ӱ�죬��P1��P2
C��ͼ������Dz�ͬ�¶ȶԷ�Ӧ��Ӱ�죬��T1��T2
D��ͼ�������ͬ��ͬѹ�£��������ܣ�1��2
��1����(����)�� ��2��2, =����3��D
����:
��1����H-T��S��0����Ӧ�Է����С�������Ŀ���ݣ�����ʱ��T��С����H-T��S��0����Ӧ�����Է����С� ��2��K=1/0.5=2����ʱN2��H2��NH3�����ʵ���Ũ�ȷֱ�Ϊ4mol/L��2mol/L��4mol/L��C(N2)C(H2)3 /C(NH3)2=2,������ƽ��״̬ ��3������ͼ���������ؼ���һץ�յ㣬�յ�ĺ�����ԽС��˵���ﵽƽ������ʱ��̷�Ӧ���ʿ죬�ɴ��¶ȸߡ�ѹǿ�����ʹ���˴�����һץˮƽ�ߣ�ˮƽ�ߵ�������Խ�����������Խ�ߣ���ӦԽ������С�


 2NH3�ġ�H
2NH3�ġ�H