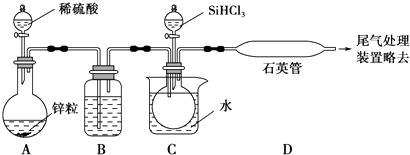
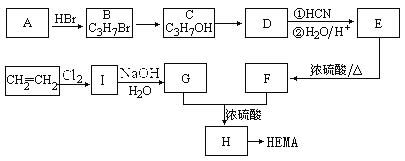
题目内容
【题目】(1)已知: 2SO2(g)+O2(g)![]() 2SO3(g) △H=-XkJ/mol;
2SO3(g) △H=-XkJ/mol;
2NO(g)+O2(g)![]() 2NO2(g) △H=-YkJ/mol。
2NO2(g) △H=-YkJ/mol。
则反应NO(g)+SO2(g)![]() SO3(g)+NO(g) 的△H=______ kJ/mol。
SO3(g)+NO(g) 的△H=______ kJ/mol。
(2)甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出热量222.5kJ,则甲烷燃烧的热化学方程式为____________。
(3)以KOH溶液为电解质溶液,依据(2)中反应设计一个原电池,其负极反应式为_______;以H2SO4溶液为电解质溶液,将甲烷燃料电池中的甲烷改为C2H5OH,其负极反应式为_________。
(4)以上述甲烷燃料电池为电源,用铂电极电解1LCu(NO3)2和KNO3混合溶液,通电一段时间,两极均产生11.2L(标准状况)气体。则电解后溶液的pH为______(电解过程中溶液体积不变),原混合溶液中Cu2+的物质的量浓度为___________,假设电解过程中能量利用率为80%,在甲烷燃料电池中消耗的甲烷在标准状况下的体积为________L。
【答案】 ![]() CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=890kJ/mol CH4+10OH8e=
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=890kJ/mol CH4+10OH8e= ![]() +7H2O C2H5OH12e+3H2O=2CO2+12H+ 0 0.5mol/L 7
+7H2O C2H5OH12e+3H2O=2CO2+12H+ 0 0.5mol/L 7
【解析】(1)①2S02(g)+O2(g)![]() 2S03(g) △H=-XkJ/mol;②2NO(g)+O2(g)
2S03(g) △H=-XkJ/mol;②2NO(g)+O2(g)![]() 2NO2(g) △H=-YkJ/mol。由(②-①)/2得,NO(g)+SO2(g)
2NO2(g) △H=-YkJ/mol。由(②-①)/2得,NO(g)+SO2(g)![]() SO3(g)+NO(g),则反应 的△H=
SO3(g)+NO(g),则反应 的△H= ![]() kJ/mol。
kJ/mol。
(2)由0.25mol甲烷完全燃烧生成液态水时放出热量222.5kJ,可以求出1mol甲烷完全燃烧生成液态水时放出热量890kJ,则甲烷燃烧的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=890kJ/mol。
(3)以KOH溶液为电解质溶液,依据(2)中反应设计一个原电池,则总反应为CH4+2O2+2OH-= ![]() +3H2O(l),其正极反应为2O2+4e-+4H2O=4OH-,所以负极反应式为CH4+10OH8e=
+3H2O(l),其正极反应为2O2+4e-+4H2O=4OH-,所以负极反应式为CH4+10OH8e= ![]() +7H2O;以H2SO4溶液为电解质溶液,将甲烷燃料电池中的甲烷改为C2H5OH,其负极反应式为C2H5OH12e+3H2O=2CO2+12H+。
+7H2O;以H2SO4溶液为电解质溶液,将甲烷燃料电池中的甲烷改为C2H5OH,其负极反应式为C2H5OH12e+3H2O=2CO2+12H+。
(4)以上述甲烷燃料电池为电源,用铂电极电解1LCu(NO3)2和KNO3混合溶液,通电一段时间,两极均产生11.2L(标准状况)气体,根据电解原理可知,阳极生成氧气、阴极生成氢气,其物质的量均为0.5mol。由于阳极只有氢氧根离子放电生成氧气,由阳极的电极反应式2H2O-4e-=O2↑+4H+可知,生成0.5molO2时转移电子2mol。根据电子转移守恒可知,阴极生成0.5molH2时,转移1mole-,所以阴极一定还析出了0.5molCu。由析出铜的总反应2Cu2++2H2O=O2↑+2Cu+4H+可知,阴极析出0.5molCu的同时生成1molH+,则电解后溶液中c(H+)=1mol/L,所以溶液的pH为0,原混合溶液中Cu2+的物质的量浓度为0.5mol/L。因为电解过程中能量利用率为80%,则在甲烷燃料电池中转移电子的物质的量为2mol![]() 80%=2.5mol,消耗的甲烷的物质的量为2.5mol
80%=2.5mol,消耗的甲烷的物质的量为2.5mol![]() 8=0.3125mol,0.3125mol甲烷在标准状况下的体积为7L。
8=0.3125mol,0.3125mol甲烷在标准状况下的体积为7L。