题目内容
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表列出了①~⑩10种元素在周期表中的位置.
请回答:
(1)这10种元素其中化学性质最不活泼的是 ,非金属性最强的是 ,形成化合物种类最多的元素是 (填元素符号).
(2)第三周期列出的六种元素对应的简单离子中半径最大的是 ;最小的是 (填离子符号).
(3)在①、②、③、④四种元素的最高价氧化物的水化物中,两性最高价氧化物的水化物与碱性最强的最高价氧化物的水化物反应的化学方程式为 ;在⑤、⑦、⑧三种元素的最高价氧化物对应的水化物中,酸性最强的是 (填化学式).
(4)对于⑦、⑧、⑩元素的氢化物,稳定性由强到弱的顺序为 ,还原性最强是 (填化学式).
(5)①~⑨的氢化物分子中与⑩的氢化物分子所含电子总数相等的分子是 (举一例即可,填化学式)
(6)表中所列的某些元素可形成既含离子键又含非极性共价键的化合物,写出其中一种化合物的化学式 .
(7)用电子式表示①与⑦形成化合物的形成过程 .
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ⑩ | |||||
| 3 | ① | ③ | ④ | ⑦ | ⑧ | ⑨ | ||
| 4 | ② |
(1)这10种元素其中化学性质最不活泼的是
(2)第三周期列出的六种元素对应的简单离子中半径最大的是
(3)在①、②、③、④四种元素的最高价氧化物的水化物中,两性最高价氧化物的水化物与碱性最强的最高价氧化物的水化物反应的化学方程式为
(4)对于⑦、⑧、⑩元素的氢化物,稳定性由强到弱的顺序为
(5)①~⑨的氢化物分子中与⑩的氢化物分子所含电子总数相等的分子是
(6)表中所列的某些元素可形成既含离子键又含非极性共价键的化合物,写出其中一种化合物的化学式
(7)用电子式表示①与⑦形成化合物的形成过程
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中的位置可知①②③④⑤⑥⑦⑧⑨⑩分别为Na、K、Mg、Al、C、O、S、Cl、Ar、F,
(1)最不活泼的元素是零族元素;结合非金属性的递变规律判断;形成化合物种类最多的元素是C元素;
(2)第三周期列出的六种元素对应的简单离子有金属阳离子和非金属的阴离子,金属阳离子核外有2个电子层,阴离子核外有3个电子层;
(3)两性最高价氧化物的水化物与碱性最强的最高价氧化物的水化物的反应为氢氧化铝与氢氧化钾的反应;非金属性越强,最高价氧化物对应水化物酸性越强;
(4)元素的非金属性越强,对应的氢化物越稳定;对应的氢化物的还原性越弱;
(5)⑩的氢化物为HF,分子所含电子总数为10;
(6)既含离子键又含非极性共价键的化合物为Na2O2;
(7)①与⑦形成化合物为Na2S.
(1)最不活泼的元素是零族元素;结合非金属性的递变规律判断;形成化合物种类最多的元素是C元素;
(2)第三周期列出的六种元素对应的简单离子有金属阳离子和非金属的阴离子,金属阳离子核外有2个电子层,阴离子核外有3个电子层;
(3)两性最高价氧化物的水化物与碱性最强的最高价氧化物的水化物的反应为氢氧化铝与氢氧化钾的反应;非金属性越强,最高价氧化物对应水化物酸性越强;
(4)元素的非金属性越强,对应的氢化物越稳定;对应的氢化物的还原性越弱;
(5)⑩的氢化物为HF,分子所含电子总数为10;
(6)既含离子键又含非极性共价键的化合物为Na2O2;
(7)①与⑦形成化合物为Na2S.
解答:
解:由元素在周期表中的位置可知①②③④⑤⑥⑦⑧⑨⑩分别为Na、K、Mg、Al、C、O、S、Cl、Ar、F,
(1)最不活泼的元素是零族元素;在元素周期表中非金属性最强的元素为F,形成化合物种类最多的元素是C元素,故答案为:Ar;F;C;
(2)六种元素对应的简单离子中半径最大的是S2-;最小的是Al3+,故答案为:S2-;Al3+;
(3)两性最高价氧化物的水化物与碱性最强的最高价氧化物的水化物的反应为氢氧化铝与氢氧化钾的反应,反应的化学方程式为Al(OH)3+KOH=KAlO2+2H2O,非金属性最强的为F,但F无正价,则最高价氧化物对应水化物酸性的为HClO4,故答案为:Al(OH)3+KOH=KAlO2+2H2O;HClO4;
(4)非金属性F>Cl>S,元素的非金属性越强,对应的氢化物越稳定,则稳定性HF>HCl>H2S,非金属性越强,对应的氢化物的还原性越弱,则还原性最强的为H2S,故答案为:HF>HCl>H2S;H2S;
(5)⑩的氢化物为HF,分子所含电子总数为10,H2O和CH4也含有10个电子,故答案为:H2O或CH4;
(6)既含离子键又含非极性共价键的化合物为Na2O2,故答案为:Na2O2;
(7)①与⑦形成化合物为Na2S,用电子式表示Na2S的形成过程为: ,
,
故答案为: .
.
(1)最不活泼的元素是零族元素;在元素周期表中非金属性最强的元素为F,形成化合物种类最多的元素是C元素,故答案为:Ar;F;C;
(2)六种元素对应的简单离子中半径最大的是S2-;最小的是Al3+,故答案为:S2-;Al3+;
(3)两性最高价氧化物的水化物与碱性最强的最高价氧化物的水化物的反应为氢氧化铝与氢氧化钾的反应,反应的化学方程式为Al(OH)3+KOH=KAlO2+2H2O,非金属性最强的为F,但F无正价,则最高价氧化物对应水化物酸性的为HClO4,故答案为:Al(OH)3+KOH=KAlO2+2H2O;HClO4;
(4)非金属性F>Cl>S,元素的非金属性越强,对应的氢化物越稳定,则稳定性HF>HCl>H2S,非金属性越强,对应的氢化物的还原性越弱,则还原性最强的为H2S,故答案为:HF>HCl>H2S;H2S;
(5)⑩的氢化物为HF,分子所含电子总数为10,H2O和CH4也含有10个电子,故答案为:H2O或CH4;
(6)既含离子键又含非极性共价键的化合物为Na2O2,故答案为:Na2O2;
(7)①与⑦形成化合物为Na2S,用电子式表示Na2S的形成过程为:
 ,
,故答案为:
 .
.
点评:本题考查元素周期表、元素周期律、常用化学用语等,为高频考点,侧重于学生的分析能力的考查,难度不大,推断元素是解题关键,注意整体把握元素周期表.

练习册系列答案
相关题目
下列关于实验原理或操作的叙述中,不正确的是( )
| A、实验室为了对配制好的溶液进行精确测定其浓度,一般选用高纯度、性质稳定、相对分子质量较大的物质做为基准物进行标定 |
| B、化学实验要注意控制条件,考虑反应物的浓度和用量,选择适宜的温度范围,以及是否要使用催化剂等 |
| C、倾析法适用于分离或洗涤结晶颗粒较大、静置后容易沉降至容器底部的沉淀 |
| D、火柴头的药粉中含有对空气敏感的易燃物质 |
在无色透明的溶液中,可以大量共存的离子组是( )
| A、H+,Na+,SO42-,NO3- |
| B、Ba2+,NH4+,OH-,MnO4- |
| C、H+,K+,Cl-,CO32- |
| D、Na+,Fe2+,NO3-,OH- |
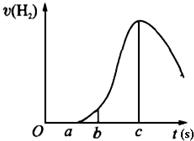 把在空气中久置的镁条7.2g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,镁条与硫酸反应产生氢气的速率与反应时间如图所示,回答下列问题:
把在空气中久置的镁条7.2g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,镁条与硫酸反应产生氢气的速率与反应时间如图所示,回答下列问题: