题目内容
3.按要求填空(1)某烃A的蒸气密度是同条件下氢气密度的64倍,则 A的分子式可能为C9H20或C10H8,若A中含有6个甲基,但不可能是烯烃与氢气的加成产物,则A的结构简式为(CH3)3CCH2C(CH3)3;
(2)已知1mol烃B中 C、H两种元素的质量比为5:1,且所含电子总数为42NA,则其分子式为C5H12,在它的同分异构体中,沸点最高的是CH3CH2CH2CH2CH3(写结构简式);一氯代物只有一种的是新戊烷(写习惯名称).
(3)在400℃,101.3k Pa时,3L某烃A在m L氧气中完全燃烧,燃烧后测得气体体积为(m+6)L(气体体积均在同温同压下测定)试回答下列问题:
①烃A的组成中应满足的条件A分子中含8个氢原子;
②若烃A在常温常压下为气态物质时,m的取值范围m≥18.
分析 (1)某烃A的蒸气密度是同条件下氢气密度的64倍,则 A的相对分子质量为64×2=128,分子中最大碳原子数目=$\frac{128}{12}$=10…8,再利用减少1个C原子添加12个H原子方法书写分子式;
若A中含有6个甲基,但不可能是烯烃与氢气的加成产物,说明相邻2个碳原子上并不都含有H原子,结合分子式确定其结构简式;
(2)C、H两种元素的质量比为5:1,则C、H原子的数目比为$\frac{5}{12}$:$\frac{1}{1}$=5:12,可知该烃的实验式为C5H12,由于H原子已经饱和碳的四价结构,所以实验式即为该烃的分子式;有3种同分异构体,分别为正戊烷、异戊烷、新戊烷.支链越多,沸点越低,沸点最高的为正戊烷,一氯代物只有一种的是新戊烷;
(3)①烃燃烧通式CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O,400℃时,生成的水为气态,利用气体体积差量计算;
②烃A在常温下为气态,则x≤4,然后根据3L A完全燃烧消耗氧气的量确定m的范围.
解答 解:(1)某烃A的蒸气密度是同条件下氢气密度的64倍,则 A的相对分子质量为64×2=128,分子中最大碳原子数目=$\frac{128}{12}$=10…8,故烃A的分子式为C9H20或C10H8,若A中含有6个甲基,但不可能是烯烃与氢气的加成产物,说明相邻2个碳原子上并不都含有H原子,则A的结构简式为(CH3)3CCH2C(CH3)3,
故答案为:C9H20或C10H8;(CH3)3CCH2C(CH3)3;
(2)C、H两种元素的质量比为5:1,则C、H原子的数目比为$\frac{5}{12}$:$\frac{1}{1}$=5:12,可知该烃的实验式为C5H12,由于H原子已经饱和碳的四价结构,所以实验式即为该烃的分子式;有3种同分异构体,分别为正戊烷、异戊烷、新戊烷.支链越多,沸点越低,沸点最高的为CH3CH2CH2CH2CH3,一氯代物只有一种的是新戊烷,
故答案为:C5H12;CH3CH2CH2CH2CH3;新戊烷;
(3)设烃的分子式为CxHy,则:
CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O(g) 气体体积差量△V
1 (x+$\frac{y}{2}$-x-$\frac{y}{4}$-1)=$\frac{y}{4}$-1
3L (m+6-m-3)L=3L
故$\frac{y}{4}$-1=1,解得:y=8,
即该烃的分子式为:CxH8,说明烃A分子中含8个氢原子,
故答案为:A分子中含8个氢原子;
②若烃A在常温常压下为气态物质时,CxH8中的x必须满足x≤4,则:x+$\frac{8}{4}$≤$\frac{mL}{3L}$,解得:m≥3x+6,所以m≥18,
故答案为:m≥18.
点评 本题考查有机物分子结构的确定方法,属于拼合型题目,要求学生具有分析和解决问题的能力,难度中等.

| A. | 可能有甲烷 | B. | 一定有乙烯 | C. | 可能有丙炔 | D. | 一定无C4H4 |
| A. |  | B. | Fe3+ | C. |  | D. |  |
| 温度/℃ | 25 | T2 |
| 水的离子积常数 | 1×10-14 | 1×10-12 |
(1)T2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11,此溶液中各种离子的浓度由大到小的顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-).
(2)25℃时,用0.01mol/LNaOH溶液滴定0.02mol/L 的硫酸,中和后加蒸馏水稀释到5mL,若滴定时终点判断有误差;①多加了1滴NaOH溶液②少加1滴NaOH溶(设1滴为0.05mL),则①和②溶液中c(OH-)之比是106:1.
(3)25℃时,0.1mol/L的NaHCO3溶液的pH为8,同浓度的NaAlO2溶液的pH为11.将两种溶液等体积混合,可能发生的现象白色沉淀_此空删去其主要原因是(用离子方程式表示)HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-_.
(4)含有Cr2O${\;}_{7}^{2-}$的废水毒性较大,某工厂废水中含5.00×10-3 mol•L-1的Cr2O${\;}_{7}^{2-}$.为使废水能达标排放,做如下处理:Cr2O${\;}_{7}^{2-}$$→_{H+}^{绿矾}$Cr3+、Fe3+$\stackrel{石灰水}{→}$Cr(OH)3、Fe(OH)3.欲使10L该废水中的Cr2O${\;}_{7}^{2-}$完全转化为
Cr3+,则理论上需要加入83.4 g FeSO4•7H2O.若处理后的废水中残留的c(Fe3+)=2×10-13 mol•L-1,则残留的Cr3+的浓度为3×10-6 mol•L-1(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31).
| A. | 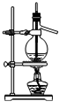 石油的分馏 | B. | 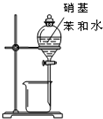 分离硝基苯和水 | ||
| C. | 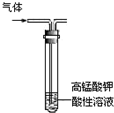 除去甲烷中的乙烯 | D. | 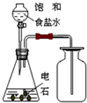 制取并收集乙炔气体 |
| A. | 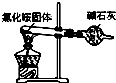 如图是氨气发生装置 | B. | 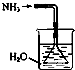 如图是氨气吸收装置 | ||
| C. | 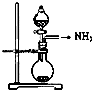 如图是氨气发生装置 | D. | 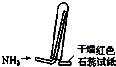 如图是氨气收集、检验装置 |
 如下表是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题
如下表是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题 | ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||
| ⑦ | ⑧ | ⑨ | |||||||||||||||
(2)②、⑥两元素形成的化合物的空间构型为平面正三角形,其中心原子的杂化类型为sp2.
(3)写出元素⑧基态原子的电子排布式1s22s22p63s23p63d104s1.
(4)比较:第一电离能:③<④,电负性:④<⑤(填“>”或“<”或“=”).
(5)元素⑦与CO可形成的X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于分子晶体(填晶体类型).
(6)元素⑨的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为配位键.
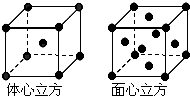
(7)金属⑦的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为2:1.
Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为SO2.
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是黑色沉淀中不含有CuO.
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
| 装置 | 现象 | 结论及解释 |
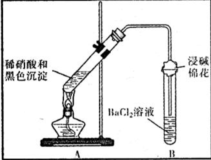 | ①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 | a.现象②说明褐色沉淀具有 还原性性. b.试管B中产生白色沉淀的总反应的离子方程式为 NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+ |
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2 溶液反应完全.则混合物中Cu2S 的质量分数为40%.



