题目内容
19.根据碘与氢气反应的热化学方程式判断正确的是( )①I2(g)+H2(g)?2HI(g)+Q1
②I2(s)+H2(g)?2HI(g)-Q2.
| A. | 1mol I2(g)与1mol H2(g)充分反应放热Q1 kJ | |
| B. | 1mol气态碘与1mol固态碘所含的能量相差(Q1+Q2)kJ | |
| C. | 反应①的生成物总能量比反应②的生成物总能量高 | |
| D. | 稳定性:I2(g)>I2(s) |
分析 热化学方程式的理解问题,并且注意热化学方程式的表达与现行教材中表达不一样,①是放热反应,②是吸热反应,化学方程式的书写一般是结合计算进行考查,所以应分两步:(1)写,特别注意注明各物质的状态,计量数可以是分数;(2)算,根据题意计算反应热;并注意盖斯定律在计算反应热中的应用来解答.
A、反应是可逆反应不能进行彻底;
B、依据盖斯定律结合热化学方程式计算得到固体碘和气体碘转化的热量变化;
C、产物均为碘化氢,能量相同;
D、状态不同相同物质气体能量高于固体,能量越高越活泼;
解答 解:A.因为是可逆反应,所以不能进行完全,反应吸热小于Q1 kJ,故A错误;
B、根据盖斯定律,用题干中热化学方程式②-①得到I2(S)?I2(g)-(Q1+Q2),故B正确;
C、两个反应中的产物均为HI,能量相同,稳定性相同,故C错误;
D、气体I2比固体I2能量高,能量越高越活泼,故D正确;
故选B.
点评 本题考查了热化学方程式的知识应用,主要考查可逆反应不能进行彻底,焓变是完全反应是的能量变化,盖斯定律的应用,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.一定条件下,反应2NO(g)+2CO(g)?2CO2(g)+N2(g)△H能够自发进行.下列有关判断正确的是( )
| A. | △H>0,△S>0 | B. | △H>0,△S<0 | C. | △H<0,△S>0 | D. | △H<0,△S<0 |
15.所含电子总数相等的微粒叫等电子体,下列各组微粒属于等电子体的是( )
| A. | HCl和F2 | B. | NO和CO | C. | NH2-和NH4+ | D. | CH4和H2S |
14.下列有关煤化工和石油化工的说法正确的是( )
| A. | 石油的炼制过程都是化学变化 | |
| B. | 煤干馏的液态产物主要有煤焦油、粗氨水 | |
| C. | 石油裂解是为了提高汽油等轻质油的产量 | |
| D. | 煤的液化是物理变化,煤的气化是化学变化 |
4.在恒容密闭容器中发生反应A(g)+B(g)?C(g)+D(?)+Q,其中B为紫色,A、C、D皆为无色,D的状态不明确.下列选项中能够确定上述容器中反应已达平衡的是( )
| A. | 密度不变 | B. | 温度不变 | C. | 颜色不变 | D. | 压强不变 |
11.用NA表示阿佛加德罗常数,下列有关水的说法正确的是( )
| A. | 标准状况下,2.24L水所含的分子数目为0.1NA | |
| B. | 9g水中含有的电子数目为0.5NA | |
| C. | 18g重水中含有的中子数为NA | |
| D. | 常温常压下,23g 酒精溶于50g水中,所得溶液中溶质的微粒数为0.5NA |
8.无法实现的反应是( )
| A. | 酸和酸反应生成酸 | |
| B. | 只有氧化剂的氧化还原反应 | |
| C. | 盐和盐反应生成碱 | |
| D. | 一种碱通过化合反应生成一种新的碱 |
9.将一定体积的CO2缓慢地通入V L NaOH溶液中,已知NaOH完全反应,若在反应后的溶液中加入足量石灰水,得到a g沉淀;若在反应后的溶液中加入足量CaCl2溶液,得到b g沉淀,则下列说法正确的是( )
| A. | 参加反应的CO2的体积为0.224 a L | |
| B. | 若a=b,则CO2与NaOH溶液反应的产物中盐只有Na2CO3 | |
| C. | b可能等于a、小于a或大于a | |
| D. | 不能确定NaOH溶液的物质的量浓度 |
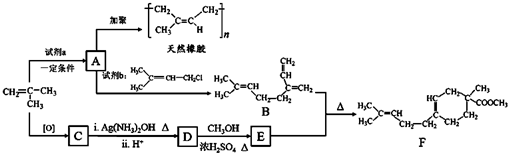
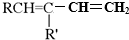
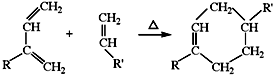 (R、R′可以是氢原子、烃基或官能团)
(R、R′可以是氢原子、烃基或官能团) .
.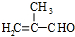 .
.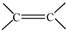 和
和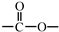 结构的D的所有同分异构共有7种(不包括顺反异构体),写出其中任意两种的结构简式CH2=CHCH2COOH、CH2=CHCOOCH3等.
结构的D的所有同分异构共有7种(不包括顺反异构体),写出其中任意两种的结构简式CH2=CHCH2COOH、CH2=CHCOOCH3等.