题目内容
17.下列制取硝酸铜的方法最正确的是( )| A. | Cu+HNO3(浓)→Cu(NO3)2 | |
| B. | Cu+HNO3(稀)→Cu(NO3)2 | |
| C. | Cu$→_{△}^{空气}$ CuO $\stackrel{稀硝酸}{→}$Cu(NO3)2 | |
| D. | Cu $→_{△}^{浓硫酸}$CuSO4 $\stackrel{Ba(NO_{3})_{2}}{→}$Cu(NO3)2 |
分析 制备硝酸铜,应尽量节省原料,且减少或杜绝污染性气体的排放,结合反应的方程式解答该题.
解答 解:A.Cu+4 HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,NO2是有毒气体,污染环境,故A错误;
B.3 Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,NO是有毒气体,污染环境,故B错误;
C.2Cu+O2=2CuO,CuO+2HNO3=Cu(NO3)2+H2O,该反应过程没有有毒气体生成,不污染环境,故C正确;
D.Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,SO2是有毒气体,污染环境,故D错误.
故选C.
点评 本题是从“绿色化学”视角考查化学知识,“绿色化学”要求设计安全的、对环境友好的合成路线,降低化学工业生成过程中对人类健康和环境的危害,减少废弃物的产生和排放.

练习册系列答案
相关题目
7.实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2=CH2+H2OCH2=CH2Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.
用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据如右:
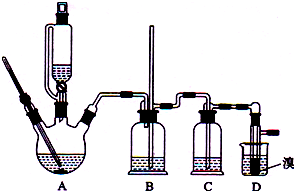
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母,下同)
a.引发反应 b.加快反应速度 c.防止乙醇挥发d.减少副产物乙醚生成
(2)反应过程中A装置可能产生的酸性干扰气体SO2(填化学式),为此在装置C中应加入c(从下列选项中选择)以吸收除杂.
a.水 b.浓硫酸 c.氢氧化钠溶液 d.高锰酸钾溶液
(3)装置B是安全瓶,其工作原理是当装置发生堵塞时,B装置中液体会压入的长玻璃导管,甚至溢出导管,以观测和缓解气压增大.
(4)若产物中有少量未反应的Br2,最好用下列试剂中的c洗涤(填选项符号),再通过分液的方法分离;
a.水 b.氢氧化钠溶液 c.NaHSO3溶液 d.苯
(5)若产物中有少量副产物乙醚,可用蒸馏的方法除去;
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2=CH2+H2OCH2=CH2Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.
用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据如右:

| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母,下同)
a.引发反应 b.加快反应速度 c.防止乙醇挥发d.减少副产物乙醚生成
(2)反应过程中A装置可能产生的酸性干扰气体SO2(填化学式),为此在装置C中应加入c(从下列选项中选择)以吸收除杂.
a.水 b.浓硫酸 c.氢氧化钠溶液 d.高锰酸钾溶液
(3)装置B是安全瓶,其工作原理是当装置发生堵塞时,B装置中液体会压入的长玻璃导管,甚至溢出导管,以观测和缓解气压增大.
(4)若产物中有少量未反应的Br2,最好用下列试剂中的c洗涤(填选项符号),再通过分液的方法分离;
a.水 b.氢氧化钠溶液 c.NaHSO3溶液 d.苯
(5)若产物中有少量副产物乙醚,可用蒸馏的方法除去;
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
5.无论在化学实验室还是在家中进行实验或探究活动,都必须注意安全.下列实验操作正确的是( )
| A. | 用蒸发皿加热NaCl溶液 | |
| B. | 不慎将汞滴落到桌面上,应立即用较多的水冲洗 | |
| C. | 从试剂瓶中取出的一些Na2CO3溶液放入试管中,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| D. | 用瓷坩埚熔化氢氧化钠 |
2.下列物质中,在O3和Zn/H2O的作用下能生成 的是( )
的是( )
 的是( )
的是( )| A. | CH3-CH═CH-CH3 | B. | CH2═CH2 | ||
| C. | CH2═CCH3CH3 | D. |  |
9.一定温度下,向a L体积固定的密闭容器中加入2molN2(g)、1molH2(g),发生如下反应:N2(g)+3H2(g)?2NH3(g),此反应达到平衡状态的标志是( )
| A. | 相同时间内消耗n mol N2的同时消耗3n mol H2 | |
| B. | H2的体积分数不再发生变化 | |
| C. | 容器内原子总数不再发生变化 | |
| D. | 容器内气体的密度不再发生变化 |
7.实验室欲配制若干体积的1.0mol/L Na2CO3溶液,正确的方法是(假设其余各步操作正确无误)( )
| A. | 将10.6g Na2CO3溶于100mL水中 | |
| B. | 将57.2g Na2CO3•10H2O溶于少量水中,再用水稀释至200mL | |
| C. | 将20 mL 5.0mol/L Na2CO3溶液用水稀释至100mL | |
| D. | 将21.2gNa2CO3•10H2O溶于200mL水中 |
 .在工业上,用氯化钠为原料,在碱性溶液中,通过电解的方法可制得NaClO,用离子方程式表示制取NaClO的电解总反应:Cl-+H2O$\frac{\underline{\;通电\;}}{\;}$ ClO-+H2↑;.将等浓度等体积的NaClO与Na2SO3溶液混合后,两者恰好完全反应,写出混合过程的离子反应方程式ClO-+SO32-=Cl-+SO42-.
.在工业上,用氯化钠为原料,在碱性溶液中,通过电解的方法可制得NaClO,用离子方程式表示制取NaClO的电解总反应:Cl-+H2O$\frac{\underline{\;通电\;}}{\;}$ ClO-+H2↑;.将等浓度等体积的NaClO与Na2SO3溶液混合后,两者恰好完全反应,写出混合过程的离子反应方程式ClO-+SO32-=Cl-+SO42-.


